LA GIUNTA REGIONALE
Vista la L. 27.12.2006, n. 296 (Legge Finanziaria per il 2007);
Richiamato in particolare l’art. 1, comma 796, lettera z) il quale dispone che “…la disposizione di cui all’articolo 3, comma 2 del D.L. 17 febbraio 1998 n. 23, convertito nella Legge 8 aprile 1998 n. 94, non è applicabile al ricorso a terapie farmacologiche a carico del SSN, che, nell’ambito dei presidi ospedalieri o di altre strutture e interventi sanitari, assuma carattere diffuso e sistematico e si configuri, al di fuori delle condizioni di autorizzazione all’immissione in commercio, quale alternativa terapeutica rivolta a pazienti portatori di patologie per le quali risultino autorizzati farmaci recanti specifica indicazione al trattamento. Il ricorso a tali terapie è consentito solo nell’ambito delle sperimentazioni cliniche dei medicinali di cui al D.lgs. 24.06.2003, n. 211 e s.m.i. In caso di ricorso improprio si applicano le disposizioni di cui all’art. 3, commi 4 e 5 del citato D.L. 23/1998, convertito con modificazioni dalla Legge 8 aprile 1998 n. 94…”;
Atteso che, ai sensi del predetto art. 1, comma 796, lettera z) le Regioni “…provvedono ad adottare entro il 28 febbraio 2007 disposizioni per le aziende sanitarie locali…volte alla individuazione dei procedimenti applicativi delle disposizioni di cui alla presente lettera, anche sotto il profilo della responsabilità amministrativa per danno erariale. Fino alla data di entrata in vigore delle disposizioni regionali di cui alla presente lettera, tale responsabilità è attribuita al direttore sanitario delle aziende sanitarie locali…”;
Ravvisata pertanto la necessità nonché l’urgenza di ottemperare a quanto previsto dall’art. 1, comma 796, lettera z) della L. 27.12.2006, n. 296;
Ritenuto di precisare che la disposizione normativa recata dall’art. 1, comma 796, lettera z) della Finanziaria 2007, a completa garanzia del diritto alla salute dei cittadini, non preclude in modo categorico l’impiego dei medicinali per indicazioni non autorizzate ma persegue l’obiettivo di prevenire l’abuso di farmaci fuori dalle indicazioni terapeutiche a rischio della salute del cittadino, evitando l’utilizzo indiscriminato di medicinali senza l’adeguata verifica delle indicazioni terapeutiche da parte delle Agenzie Regolatorie;
Richiamata la nota del 12.02.2007 con cui il Ministro della Salute ha precisato che:
- l’art. 3 comma 2 della Legge 8 aprile 1998 n. 94, di conversione del D.L. 17 febbraio 1998 n. 23 riguarda fattispecie diverse da quelle disciplinate dall’art. 1, comma 4 del D.L. 21.10.1996, n. 536, convertito nella L. 23.12.1996, n. 648;
- di conseguenza la norma della legge finanziaria 2007 – che rende non applicabile nell’ambito degli ospedali e delle altre strutture la facoltà prevista dall’art. 3 comma 2 della Legge 8 aprile 1998 n. 94 – riguarda fattispecie non disciplinate dall’art. 1, comma 4 del D.L. 21.10.1996, n. 536, convertito nella L. 23.12.1996, n. 648, la cui vigenza resta del tutto impregiudicata;
Atteso altresì che – nella predetta nota del 12.02.2007 - il Ministro della Salute ha espressamente richiesto all’Agenzia Italiana del Farmaco (A.I.F.A.) di rivedere e aggiornare l’elenco dei farmaci predisposto in attuazione dell’art. 1, comma 4 del D.L. 21.10.1996, n. 536, convertito nella L. 23.12.1996, n. 648, individuando ulteriori medicinali in commercio che, a giudizio della C.T.S. (Commissione Tecnico Scientifica già Commissione Unica del Farmaco) possano essere impiegati con onere a carico del SSN, a particolari condizioni indicate dalla stessa C.T.S., per patologie non comprese tra le indicazioni terapeutiche autorizzate, in mancanza di valida alternativa terapeutica, con particolare riguardo ai settori dell’oncologia, della pediatria e delle terapie avanzate;
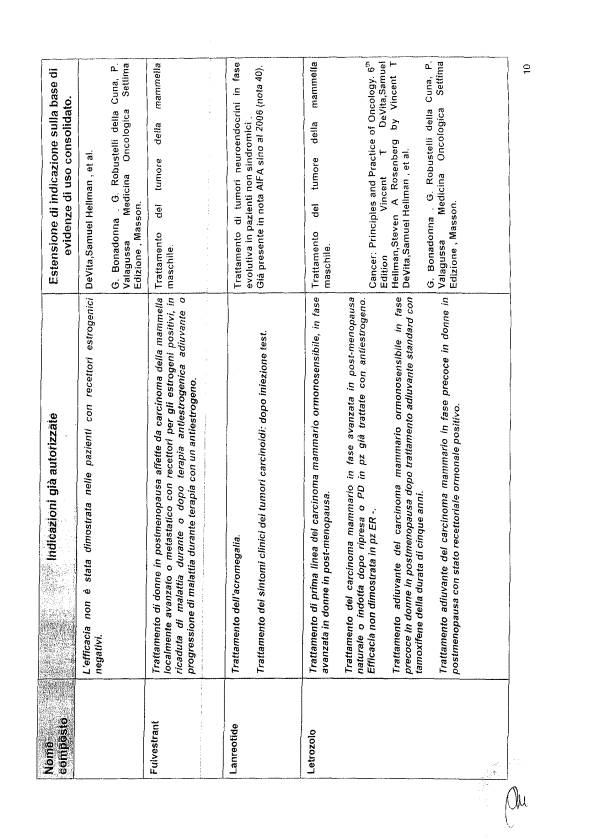
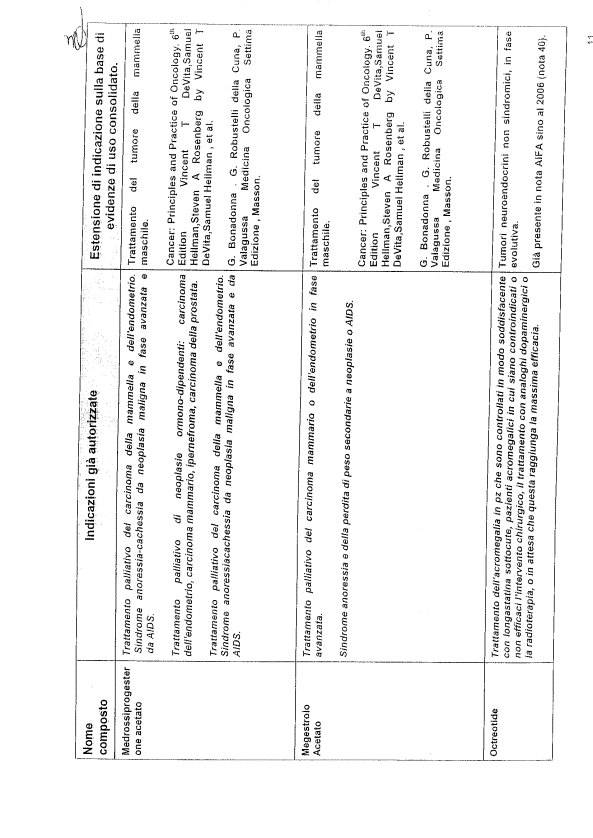
Richiamata la nota del 06.04.2007 (All. 1) - parte integrante e sostanziale del presente atto - con cui l’Agenzia Italiana del Farmaco (A.I.F.A.), in ottemperanza a quanto richiesto nella nota del 12.02.2007 del Ministro della Salute, ha provveduto ad approvare una lista di farmaci oncologici con le relative indicazioni non autorizzate di uso corrente;
Precisato altresì che, come riportato nella nota stessa:
- le indicazioni non autorizzate riportate nella predetta lista sono “…sostenute da una consolidata pratica clinica e documentate a livello scientifico nei testi di riferimento della oncologia medica e presenti nelle linee guida nazionali ed internazionali in ambito oncologico…”;
- la lista ed i criteri con cui è stata stilata la lista stessa sono stati condivisi con l’Associazione Italiana di Oncologia Medica (A.I.O.M.);
- i farmaci inseriti nell’elenco sono da tempo presenti sul mercato e per molti di questi è già scaduta la copertura brevettuale;
Ribadito che, al fine di scongiurare il rischio di utilizzo off label improprio dei farmaci antitumorali di recente immissione sul mercato, è stato attivato presso l’A.I.F.A. il Registro Nazionale dei nuovi medicinali oncologici sottoposti a monitoraggio, attraverso cui è possibile valutare se ogni singolo trattamento corrisponde alla indicazione autorizzata e che costituisce preciso obbligo delle AA.SS.LL. trasmettere i dati richiesti al predetto Registro Nazionale;
Preso atto del documento avente ad oggetto “Le condizioni per la legittimità delle prescrizioni “off label”, siccome elaborato dal Servizio Assistenza Distrettuale – Assistenza Farmaceutica della Direzione Sanità (All. 2), quale parte integrante e sostanziale del presente atto, recante excursus della normativa in materia, offerto al fine di agevolare la esatta individuazione del contesto entro cui si inserisce il disposto di cui alla Legge 27.12.2006, . 296, art. 1, comma 796, lett z);
Visto il documento avente ad oggetto “Impiego di medicinali, nell’ambito del SSN, al di fuori delle condizioni di Autorizzazione all’immissione in commercio (Off-Label) – Definizione delle modalita’ applicative a livello regionale”, siccome elaborato dal Servizio Assistenza Distrettuale – Assistenza Farmaceutica della Direzione Sanità (All. A), quale parte integrante e sostanziale del presente atto, recante le disposizioni cui devono attenersi le Aziende Sanitarie della Regione Abruzzo, per l’utilizzo dei farmaci - a carico del SSR - per indicazioni terapeutiche diverse da quelle autorizzate;
Ritenuto opportuno nonché necessario:
- approvare il documento (All. A) di cui sopra, al fine di definire all’interno della Regione procedure e percorsi omogenei, che – mutuando i criteri adottati dall’A.I.F.A. all’atto dell’elaborazione della lista allegata alla nota del 06.04.2007 - garantiscano le cure più appropriate e aggiornate alle conoscenze più avanzate purchè basate esclusivamente su evidenze scientifiche inconfutabili e nel rispetto della vigente normativa in materia;
Dato atto del parere favorevole, in ordine alla regolarità tecnica ed amministrativa del presente provvedimento, espresso dal Dirigente del Servizio Assistenza Distrettuale – Assistenza Farmaceutica;
Dato atto altresì del parere favorevole, in ordine alla legittimità del presente provvedimento, espresso dal Direttore Regionale della Direzione Sanità;
A voti unanimi espressi nelle forme di legge,
DELIBERA
per le motivazioni espresse in narrativa
1. di prendere atto della lista di farmaci oncologici, con le relative indicazioni non autorizzate di uso corrente, approvata dall’ Agenzia Italiana del Farmaco (A.I.F.A.) con propria nota del 06.04.2007 (All. 1), parte integrante e sostanziale del presente atto;
2. di stabilire che la stessa sia esaustiva e vincolante per quanto riguarda i farmaci ivi riportati, in quanto le indicazioni non autorizzate riportate nella predetta lista sono sostenute da una consolidata pratica clinica e documentate a livello scientifico nei testi di riferimento della oncologia medica e presenti nelle linee guida nazionali ed internazionali in ambito oncologico;
3. di approvare il documento avente ad oggetto “Impiego di medicinali, nell’ambito del SSN, al di fuori delle condizioni di Autorizzazione all’immissione in commercio (Off-Label) – Definizione delle modalita’ applicative a livello regionale”, siccome elaborato dal Servizio Assistenza Distrettuale – Assistenza Farmaceutica della Direzione Sanità (All. A), quale parte integrante e sostanziale del presente atto, recante le disposizioni cui devono attenersi le Aziende Sanitarie della Regione Abruzzo, per l’utilizzo dei farmaci - a carico del SSR - per indicazioni terapeutiche diverse da quelle autorizzate;
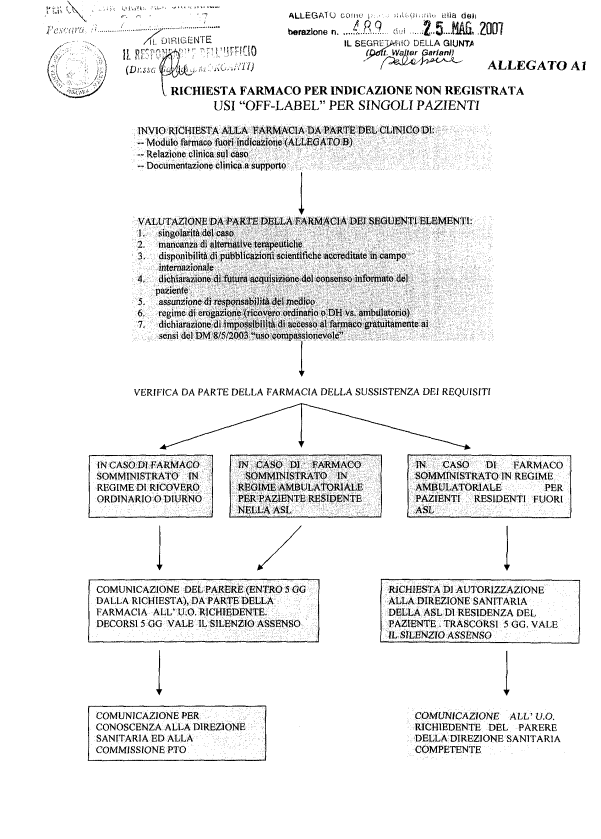
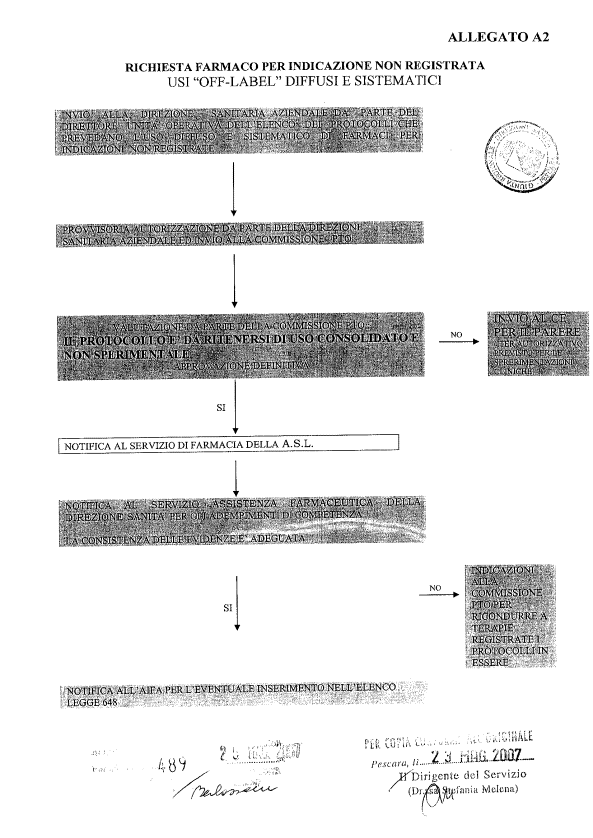
4. di approvare gli schemi riepilogativi dell’iter da seguire al fine di ottenere l’autorizzazione all’uso “off label” per singoli pazienti (All. A1) e in caso di uso “off label” diffuso e sistematico (All. A2), quali parti integranti e sostanziale del presente atto;
5. di approvare la modulistica (All. B) predisposta per la richiesta di fornitura di farmaci per indicazioni non registrate per singolo paziente), quale parte integrante e sostanziale del presente atto;
6. di dare mandato al Servizio Assistenza Distrettuale – Assistenza Farmaceutica della Direzione Sanità di modificare e/o integrare il documento (All. A) di cui al punto precedente, qualora necessario, anche su indicazione della Commissione Regionale del Farmaco;
7. di dare mandato alla Commissione Regionale del Farmaco di valutare i protocolli pervenuti dalle AA.SS.LL. e relativi ad usi diffusi e sistematici di farmaci al di fuori delle condizioni di autorizzazione, al fine dell’elaborazione di un apposito elenco regionale – all’uopo modificabile - ;
8. di precisare che l’elenco di cui al precedente punto 7 resta in vigore sino alla stesura e pubblicazione di eventuali ulteriori elenchi relativi alle diverse aree terapeutiche a cura dell’Agenzia Italiana del Farmaco;
9. di dare mandato al Servizio Assistenza Distrettuale – Assistenza Farmaceutica della Direzione Sanità di trasmettere il presente provvedimento alle Direzioni Generali delle AA.SS.LL. al fine di una tempestiva applicazione nonchè comunicazione agli operatori sanitari interessati;
10. di disporre la pubblicazione del presente provvedimento sul Bollettino Ufficiale della Regione Abruzzo ed, altresì, sul Portale della Sanità della Regione http/sanitapo.it.
Segue allegato