LA GIUNTA REGIONALE
Omissis
DELIBERA
Per quanto espresso in narrativa, che qui si intende integralmente trascritto:
1) di approvare l’allegato Programma, relativo al Piano Nazionale Residui della Regione Abruzzo per l’anno 2003, che costituisce parte integrante e sostanziale del presente atto;
2) di dare incarico come previsto dal Piano Nazionale Residui - ai Servizi Veterinari delle Aziende UU.SS.LL. di effettuare il prelievo dei campioni e all’istituto Zooprofilattico Sperimentale dell’Abruzzo e del Molise di Teramo, di effettuare le analisi dei campioni medesimi;
3) le Aziende UU.SS.LL. e l’istituto Zooprofilattico Sperimentale, ognuno per le proprie specifiche competenze, trasmettono -al Servizio Veterinario Regionale entro - il 15 dicembre 2003 una relazione consuntiva sulle attività del Programma;
4) il Dirigente del Servizio Veterinario della Direzione Sanità della Régione, è delegato all’assunzione degli atti amministrativi connessi all’applicazione del Piano in parola, ivi comprese eventuali modifiche al programma annuale;
5) di pubblicare il presente provvedimento sul B.U.R.A. (Bollettino Ufficiale della Regione Abruzzo).
REGIONE ABRUZZO

DIREZIONE SANITA'
Servizio Veterinario

PIANO
REGIONALE RESIDUI
PROGRAMMA 2003
REGIONE ABRUZZO
Direzione Regionale Sanità
Servizio Veterinario
LINEE GUIDA PER LO SVOLGIMENTO DEL PIANO NAZIONALE RESIDUI PER L’ANNO 2003, DELLA REGIONE ABRUZZO
(Nota Ministero Sanità 609/24490/AG.13/301)
Questa nota si propone di fornire le linee guida che dovranno essere seguite dai Servizi Veterinari delle AA.SS.LL. e dall’Istituto Zooprofilattico Sperimentale per l’espletamento del Piano Nazionale Residui 2003, che si struttura tenendo conto delle prescrizioni del D.L.vo 4 agosto 1999, n.336, attuazione delle direttive del Consiglio 96/22/CE e 96/23/CE .
Le finalità del piano sono quelle di esaminare ed evidenziare le ragioni dei rischi di residui negli animali e nei prodotti di origine animale a livello degli allevamenti, dei macelli, degli stabilimenti di produzione del pesce e delle uova.
I campioni vengono analizzati nei laboratori dell’ Istituto Zooprofilattico Sperimentale dell’Abruzzo e Molise “G. Caporale” o, per la ricerca di particolari molecole, presso altri laboratori che verranno individuati dal Ministero della sanità.
Gli esiti del campionamento vengono trasmessi semestralmente al Ministero della Salute e con comunicazione immediata, anche via e-mail, in caso di positività. I dati semestrali devono essere tassativamente trasmessi entro il 31 luglio 2003 ed il 31 gennaio dell'anno successivo.
Il PNR è riferito al periodo 1 gennaio e termina il 31
dicembre 2003.
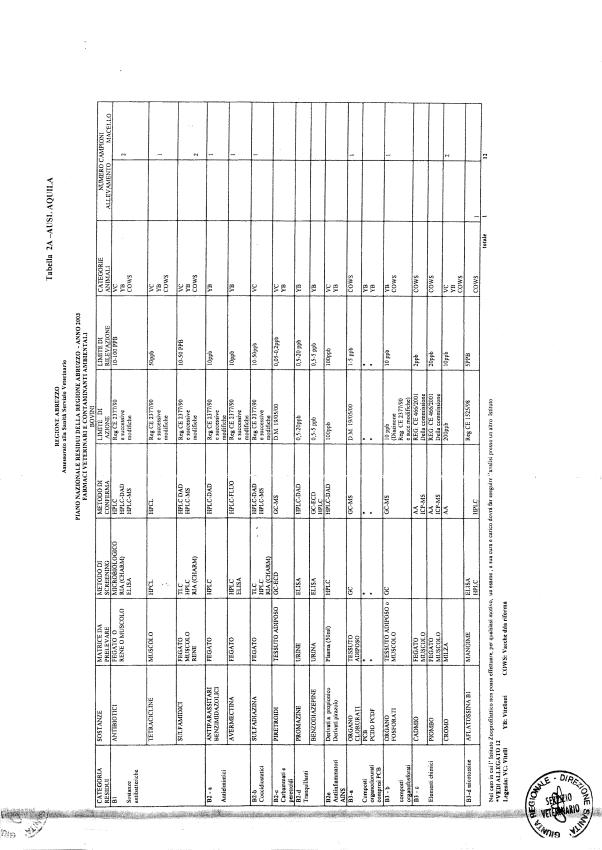
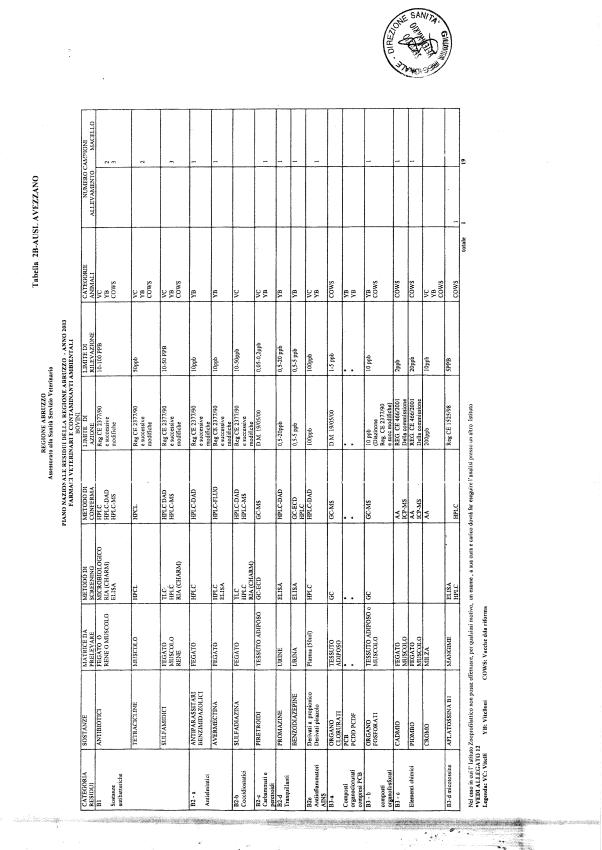
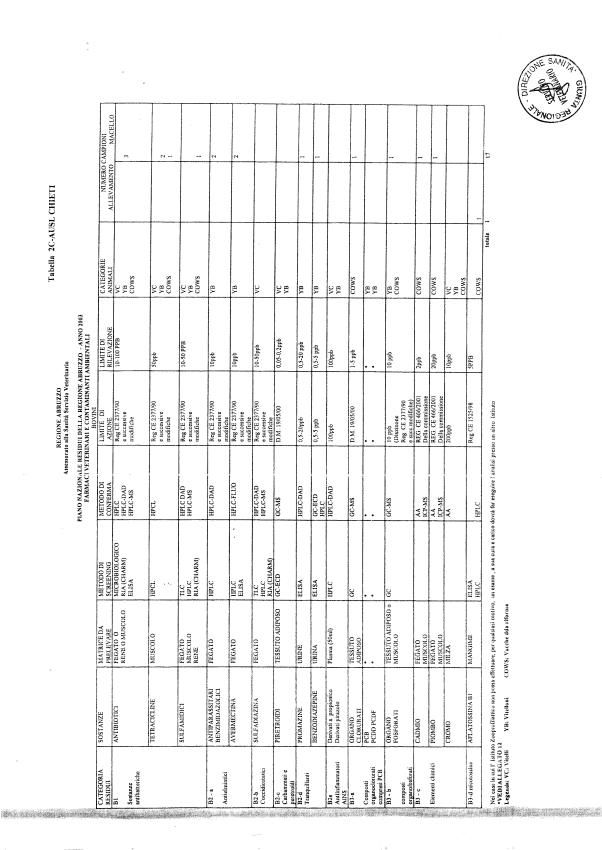
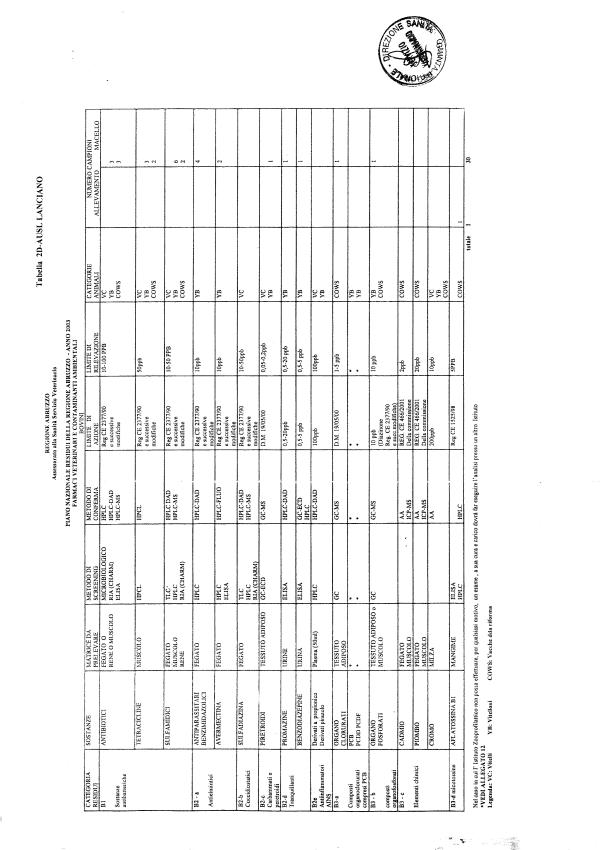
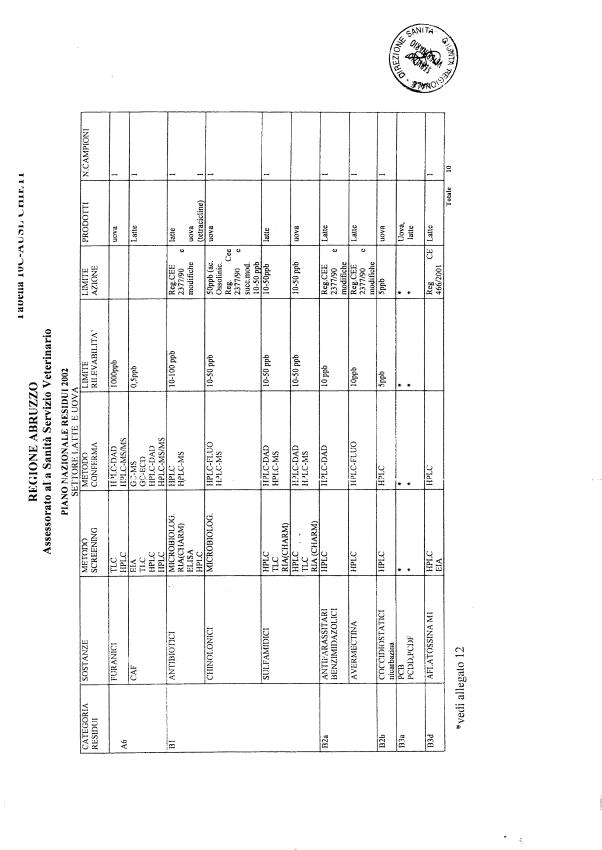
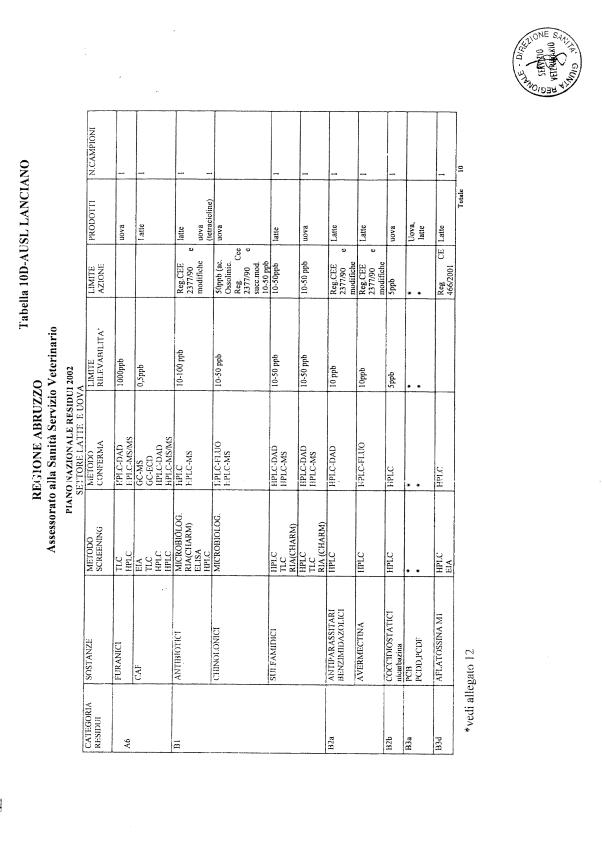
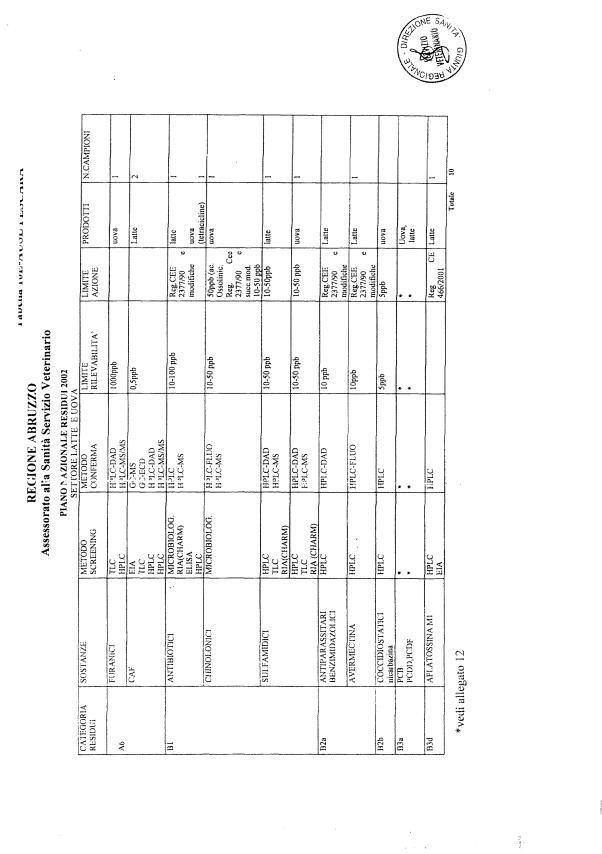
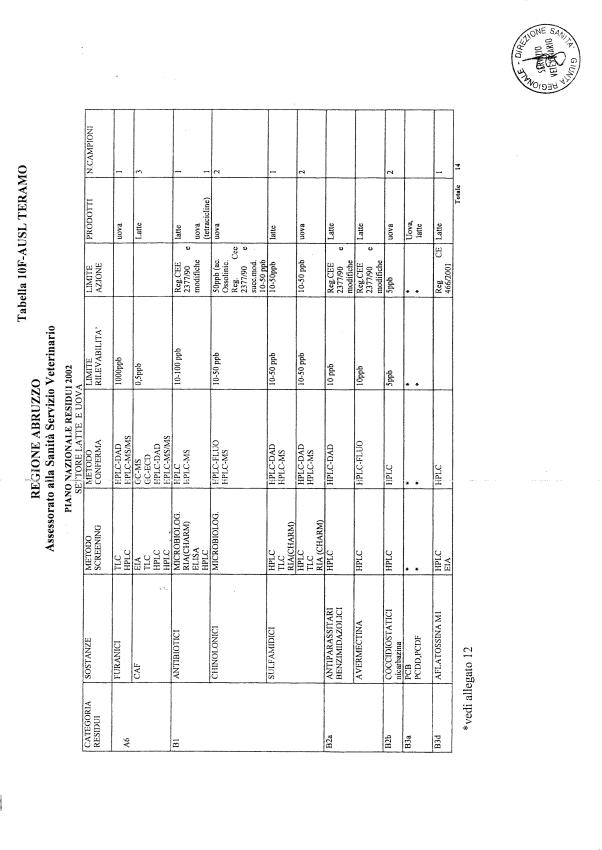
Per la Regione Abruzzo, comporta la ricerca dei residui nei seguenti settori:
- bovino, suino, ovi-caprino, equino
- avicolo
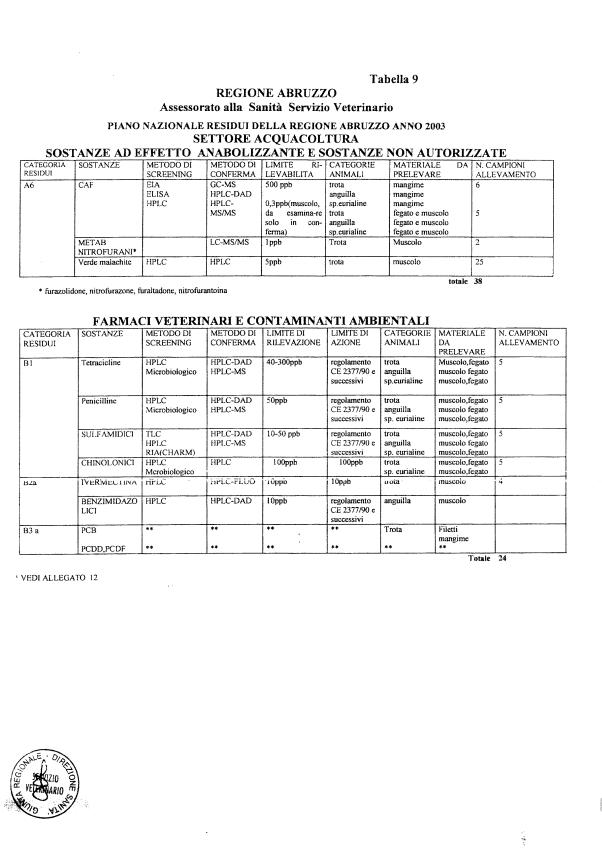
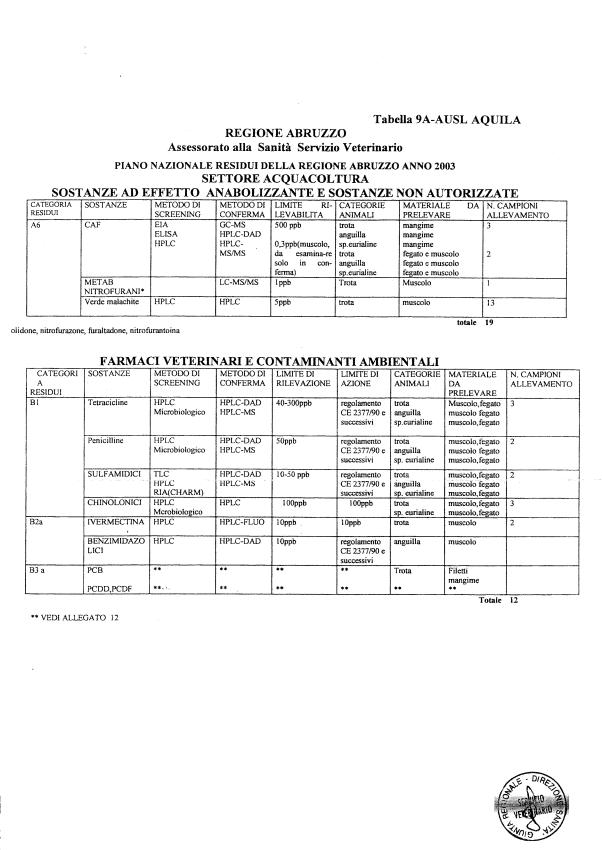
- settore acquacoltura (trote, anguille, specie eurialine)
- conigli
- selvaggina d'allevamento (selvaggina da penna)
- latte (vaccino, ovino, bufalino)
- uova
- miele
- selvaggina cacciata.
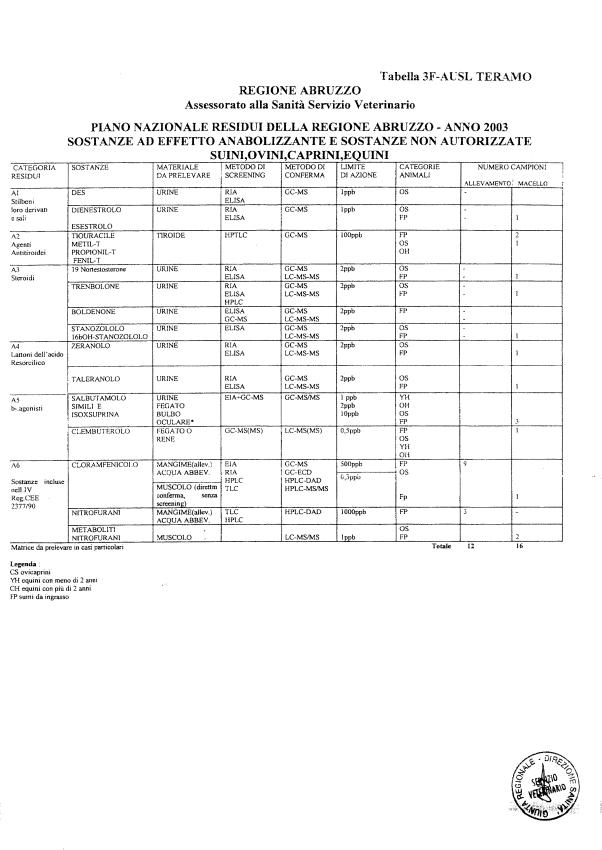
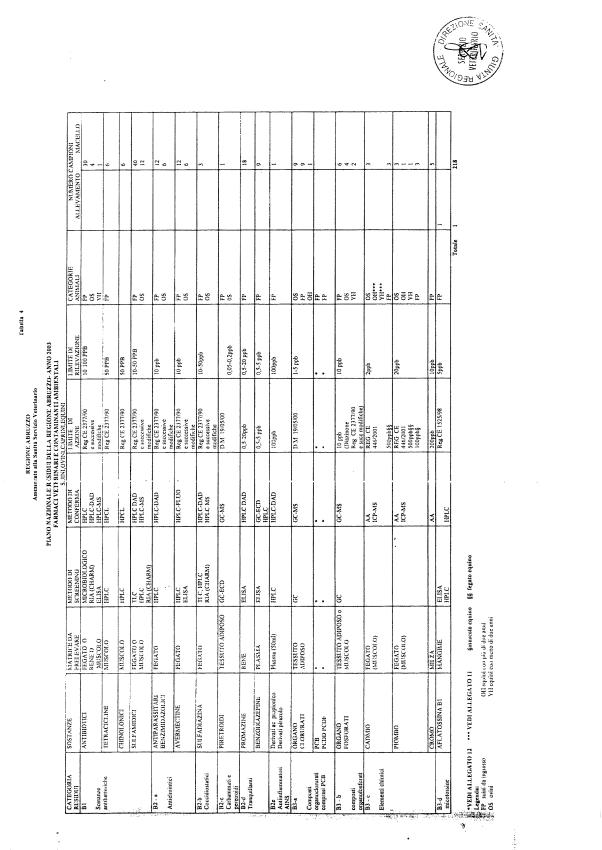
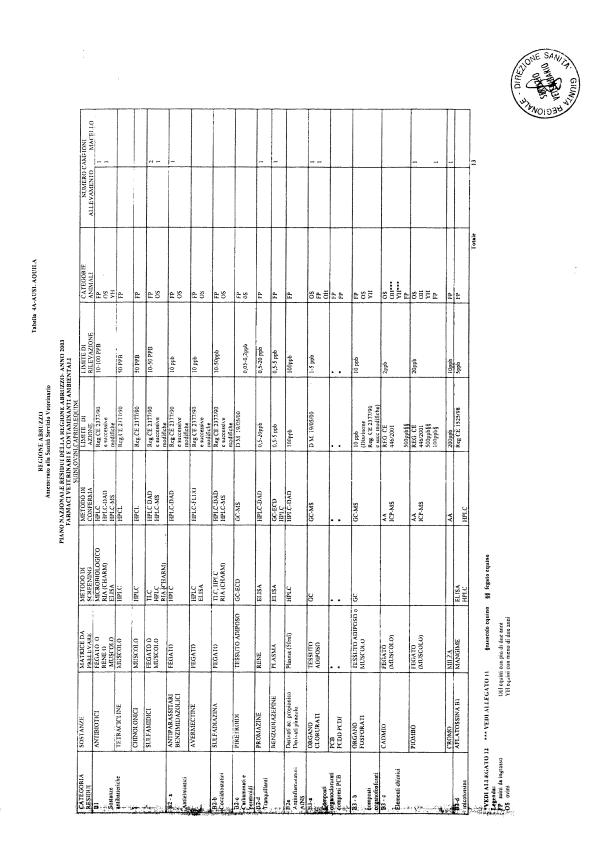
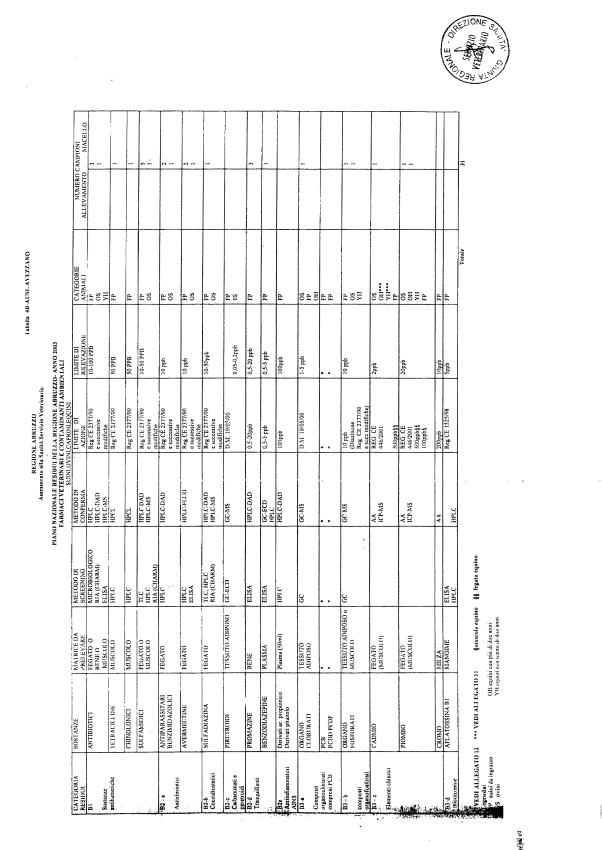
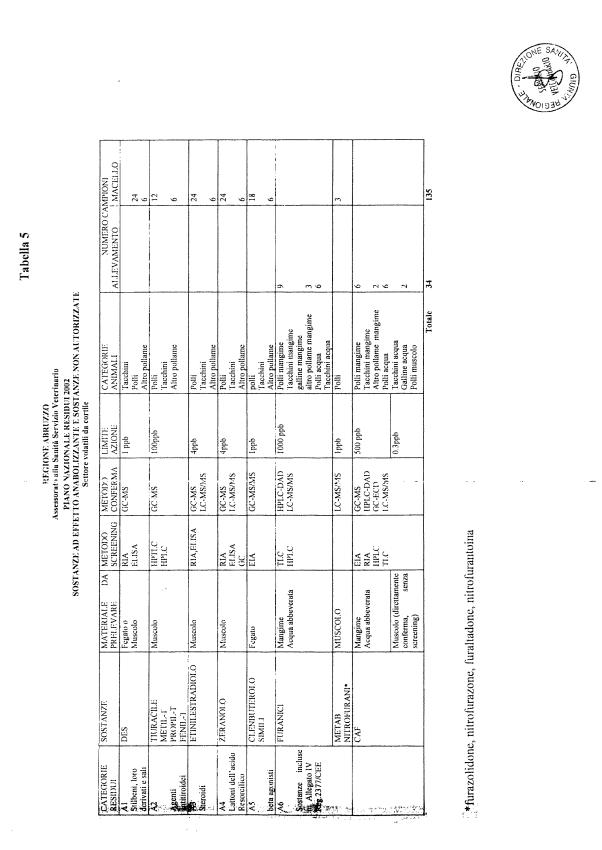
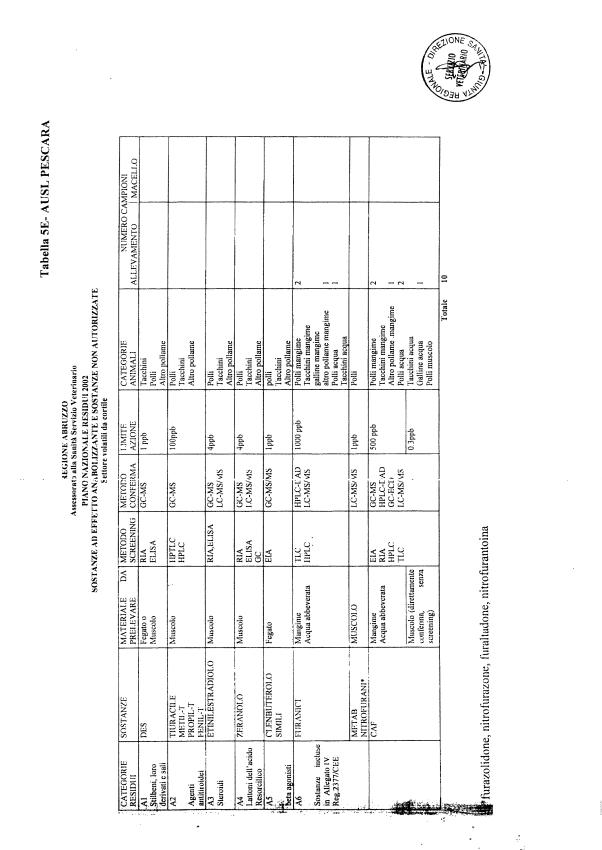
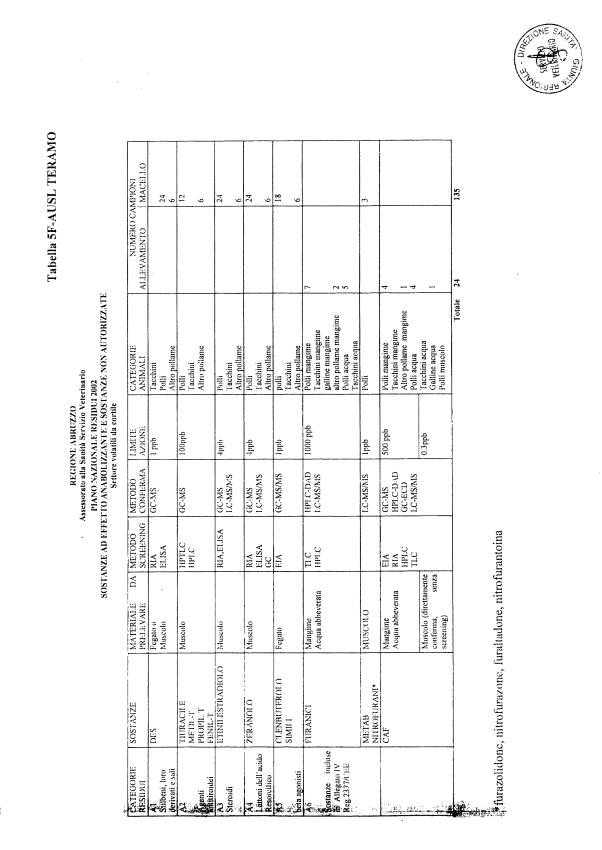
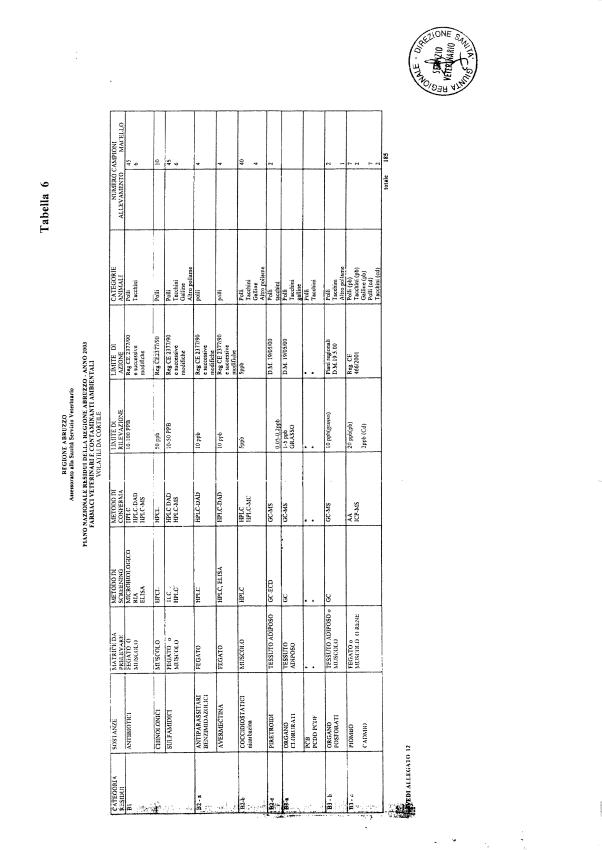
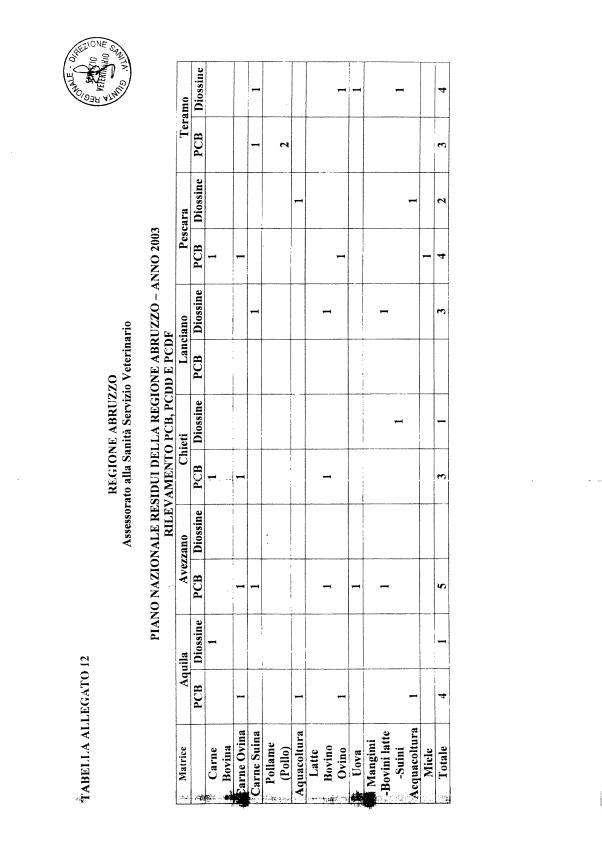
La programmazione per il 2003 è riportata nelle tabelle da 1 a 13 nonchè negli allegati 11 e 12, per quanto riguarda la ricerca del cadmio negli equini e la ricerca dei PCB e delle Diossine nelle varie matrici.
Nel PNR 2003, in conformità alle richieste comunitarie, sono state inserite la ricerca del clenbuterolo in bovini, suini, ovini, caprini ed equini, mediante tecniche specifiche non multiresiduo, e la ricerca dei metaboliti dei nitrofurani.
Le sostanze oggetto del Piano vengono raggruppate secondo la seguente classificazione (allegato 19):
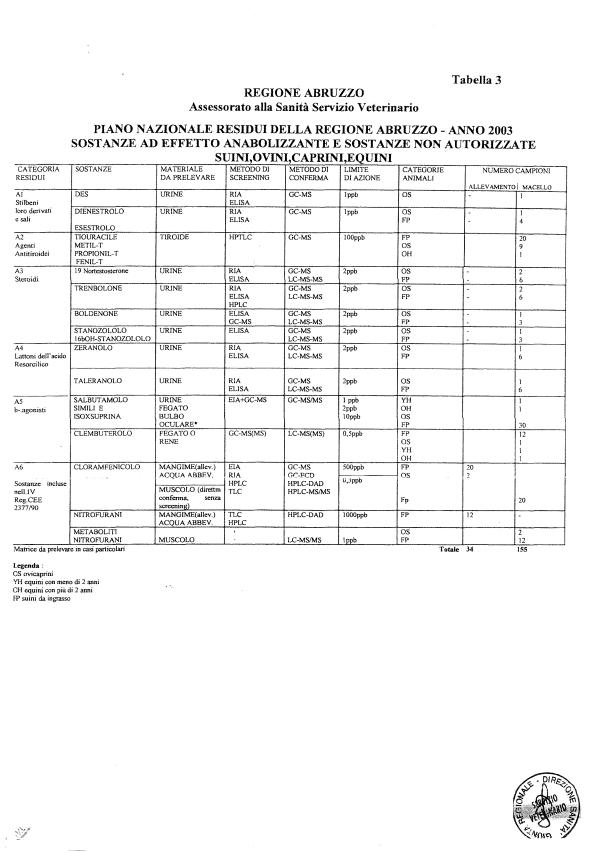
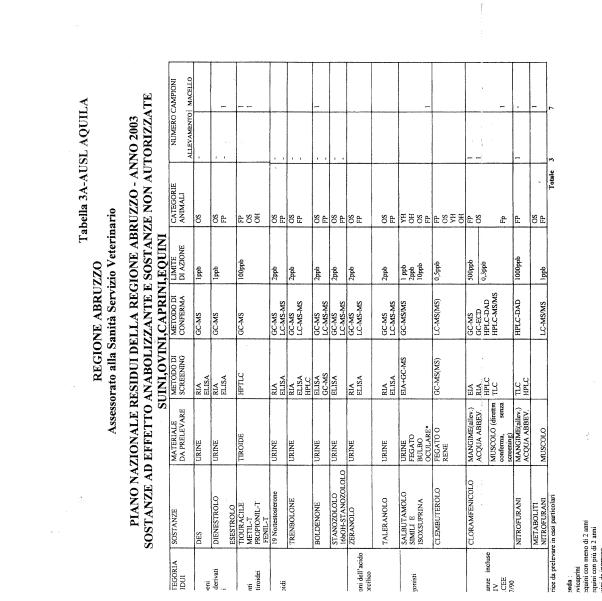
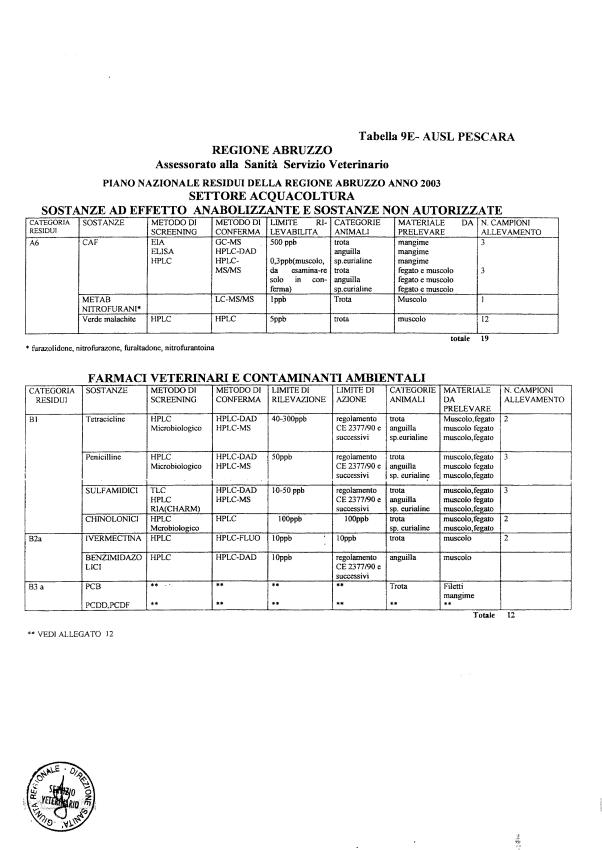
- categoria A - sostanze ad effetto anabolizzante e sostanze non autorizzate.
- categoria B - medicinali veterinari e agenti contaminanti ambientali.
Il campionamento deve essere imprevisto, inatteso ed effettuato in momenti non fissi ed in giorni non particolari della settimana compresi sabato e domenica. Affinché i risultati possano essere considerati significativi, è importante curare la distribuzione del prelievo dei campioni in modo uniforme nell'arco dell'anno.
I tipi di campionamento sono: a) campionamento casuale mirato; b) campionamento completamente casuale.
a) Campionamento casuale mirato: seppure in assenza di sospetto, prende in considerazione le caratteristiche dell'animale che lo fanno ritenere potenzialmente a rischio quali il sesso, l'età, la specie, il tipo di allevamento.
Si effettua in tutti i casi ad eccezione dei campionamenti di cui alla lettera b) .
Per la ricerca delle sostanze della categoria A che possono risultare essere fonti di gravi rischi per la salute pubblica, tra cui:
- tutte le sostanze ad azione ormonale, nonché i beta-agonisti utilizzati come promotori di crescita;
- il verde malachite nel settore acquacoltura,
si dovrà procedere al prelievo di campioni ufficiali ponendo sotto sequestro cautelativo:
- in allevamento: tutti gli animali appartenenti al gruppo sottoposto a campionamento;
- al macello, le carcasse e le relative frattaglie da cui si prelevano i campioni;
- per il settore acquacoltura, i pesci allevati nelle vasche od appartenenti al gruppo da cui sono stati prelevati i campioni.
Il sequestro durerà fino a che non sia reso noto l'esito favorevole delle analisi.
Dovranno essere prelevate 4 aliquote in allevamento e 5 aliquote al macello, di cui 1 da lasciare al proprietario o detentore degli animali, 1 al titolare del macello e le altre 3 da destinare al laboratorio.
Ogni campione dovrà essere accompagnato da tante copie del verbale quanti sono i destinatari delle aliquote, scritte in caratteri chiari e facilmente leggibili.
Si suggerisce di effettuare ad ogni campionamento casuale mirato verifiche procedurali operative conformemente all'allegato 16 .
b) Campionamento completamente casuale: consiste nel prelevare un campione a caso, senza tener conto delle caratteristiche degli animali, per ottenere dati rappresentativi.
Il campione sarà prelevato in unica aliquota e non comporterà il sequestro degli animali o dei prodotti.
Solo per la ricerca dei PCB, come specificato in allegato 12, il campione dovrà essere prelevato in due aliquote in modo da permettere in caso di positività la ricerca delle diossine sulla seconda aliquota.
Campionamento su sospetto
Oltre alle suddette tipologie di campionamento specificatamente previste per l'effettuazione del PNR, la Comunità Europea richiede la raccolta dei dati riferiti al Campionamento su sospetto.
Tale campionamento si effettua tutte le volte che, per segni clinici, notizie anamnestiche, segnalazioni, o altri motivi si sospetta la presenza di residui (compresi i casi di campionamento a seguito di riscontro di positività).
In tutti i casi di campionamento su sospetto è necessario ricorrere al sequestro.
Per il settore avicolo, i conigli e la selvaggina di piccola taglia, ogni campione potrà essere ottenuto con materiale prelevato da uno o più soggetti, seguendo le indicazioni dell'Istituto Zooprofilattico Sperimentale competente per territorio. Per quanto riguarda il campionamento in allevamento questo potrà prevedere la soppressione di uno o più soggetti in loco per consentire il prelievo delle matrici più idonee.
Per quanto riguarda il settore acquacoltura il campionamento per la ricerca delle sostanze della categoria B deve essere eseguito preferibilmente nelle ultime fasi di allevamento.
Il campionamento per la ricerca del Verde malachite va effettuato nelle prime fasi di allevamento e l'unità campionaria deve essere composta di 5 pesci frammentati da cui si ricavano le 4 aliquote. L'analisi si effettua sul materiale omogeneizzato e il risultato sarà quindi unico per la sostanza ricercata.
Il latte bovino deve essere campionato a livello di allevamento e precisamente a livello di cisterna .
I campioni devono essere prelevati unicamente sul latte crudo.
I campionamenti sulle uova devono essere effettuati a livello di allevamento o al momento di ingresso in stabilimenti di ovoprodotti in modo da poter comunque risalire all’allevamento di origine. Ogni aliquota deve essere costituita da almeno 12 uova.
Il campionamento di un alimento ad uso zootecnico (es. da un silos) non deve comportare la sospensione dell'alimentazione degli animali in attesa dei risultati d'analisi.
Per il campionamento dell’occhio in bovini superiori ai 12 mesi è necessario osservare le disposizioni per quanto riguarda gli organi specifici a rischio BSE; pertanto, è opportuno, ove possibile, limitare il prelievo di tale matrice ai bovini di età inferiore ai 12 mesi.
Per il campionamento del pelo, che può essere prelevato da animali pigmentati, esso deve avvenire preferibilmente sulla parte dorsale del mantello, privilegiando le zone a più intensa pigmentazione (maggiormente ricche di melanina).
Il prelevatore deve essere dotato di indumenti di protezione individuale, quali cappello, mascherina, camice e guanti monouso. Per il prelievo utilizzare forbici facilmente pulibili dopo ogni prelievo o materiale monouso, quali rasoi. Ogni aliquota deve essere costituita da almeno 1 grammo di pelo, da inserire in buste o sacchetti di plastica da sigillare in modo inviolabile.
Dopo ogni prelievo, mettere in atto le opportune procedure di decontaminazione dei materiali (forbici, rasoi).
Ai fini di un corretto prelievo dei campioni ci si deve attenere a quanto previsto nell'allegato 15 .
Gli Istituti Zooprofilattici Sperimentali non accettano campioni che non risultino pienamente conformi a quanto indicato all’allegato 15 o che siano accompagnati da verbali non correttamente compilati. Gli IZS, nel caso in cui non accettino dei campioni, compilano una scheda di non conformità, di cui, a titolo d'esempio, si riporta un modello all'allegato 20, e segnalano il caso alla Regione e alla AUSL di competenza.
Per una efficace gestione del PNR hanno infatti la massima importanza la regolarità e l'uniformità con cui vengono forniti i dati e le informazioni di attività.
Il programma FINSIEL per la gestione computerizzata dei dati relativi al PNR e' stato installato presso le sedi centrali degli Istituti Zooprofilattici Sperimenatali e presso le Regioni e le Provincie autonome.
Per permettere la gestione dei dati relativi ai campioni si rende necessario uniformare le informazioni riportate sul verbale di prelevamento che devono comprendere:
1) indicazione del Piano per cui è stato prelevato il campione (Nazionale, Regionale, ecc.)
2) specie animale (es. bovino)
3) categoria dell'animale (es. vitellone)
4) sesso dell'animale
5) provenienza (allevamento, macello)
6) materiale prelevato
7) esami richiesti
8) data prelievo
9) Paese d'origine degli animali
10) nome allevamento
11) codice allevamento
12) indirizzo
13) AUSL
14) Ente prelevatore
15) tipo di campionamento
16) Per i bovini : età superiore o inferiore a 6 mesi
17) Per gli equini: età superiore o inferiore a 2 anni
18) Medicinali veterinari con cui sono stati trattati gli animali nelle 4 settimane precedenti il campionamento (nel caso di campionamento in allevamento)
In allegato 13 si riporta, a titolo d'esempio, un modello di verbale di prelevamento.
Le Regioni possono far inserire nel verbale alcune specifiche, quale, ad esempio, l'indicazione dei giorni presunti che intercorrono tra il campionamento e la macellazione. In tal modo gli IZS possono individuare delle difformità che, seppur non essendo causa di non accettazione del campione, presuppongono la segnalazione del caso alla Regione di competenza.
Chiarimenti su alcune ricerche
La ricerca delle diossine e dei PCB va effettuata conformemente a quanto previsto nell'allegato 12. I campioni per la ricerca delle Diossine vanno inviati all'IZS dell'Abruzzo e del Molise.
L’Istituto Zooprorilattico Sperimentale dell’Abuzzo e Molise effettua le analisi previste dal PNR, in via prioritaria per quanto riguarda la ricerca di sostanze della categoria A.
I tempi di risposta dovranno essere i più brevi possibili ed orientativamente non dovranno superare i 7 giorni lavorativi per le carni bovine e di 4 giorni lavorativi per le specie suinicole, ovi-caprine, avi-cunicole dalla consegna del campione al laboratorio per le analisi in presenza di vincolo sanitario, salvo la necessità di ulteriori approfondimenti analitici.
Le risposte potranno essere trasmesse anche via telefax, E Mail, in particolar modo per quanto attiene gli animali e i prodotti sotto sequestro, a cui farà comunque seguito la trasmissione in originale.
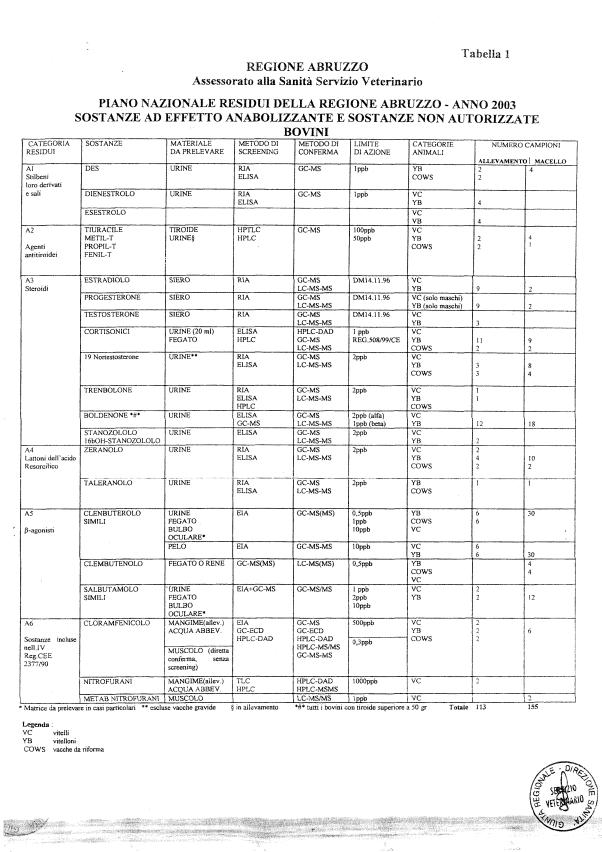
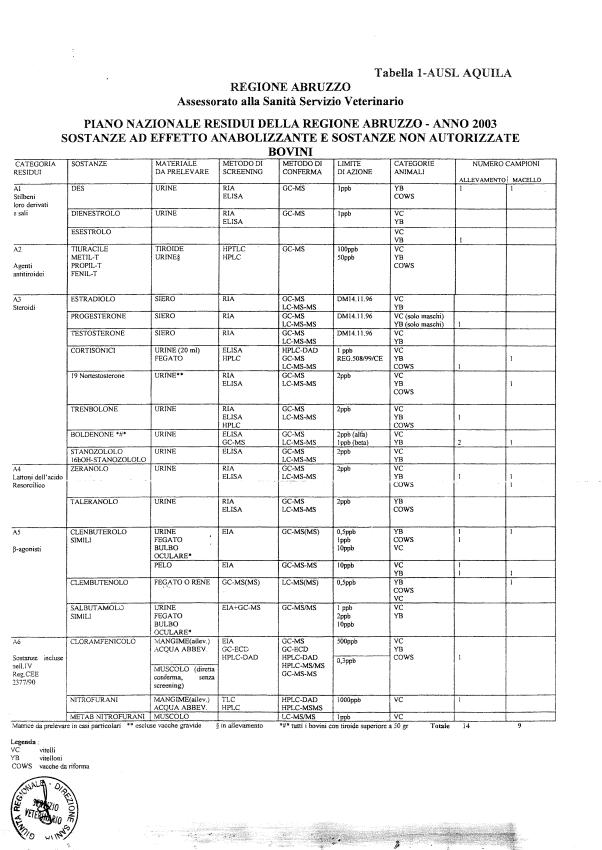
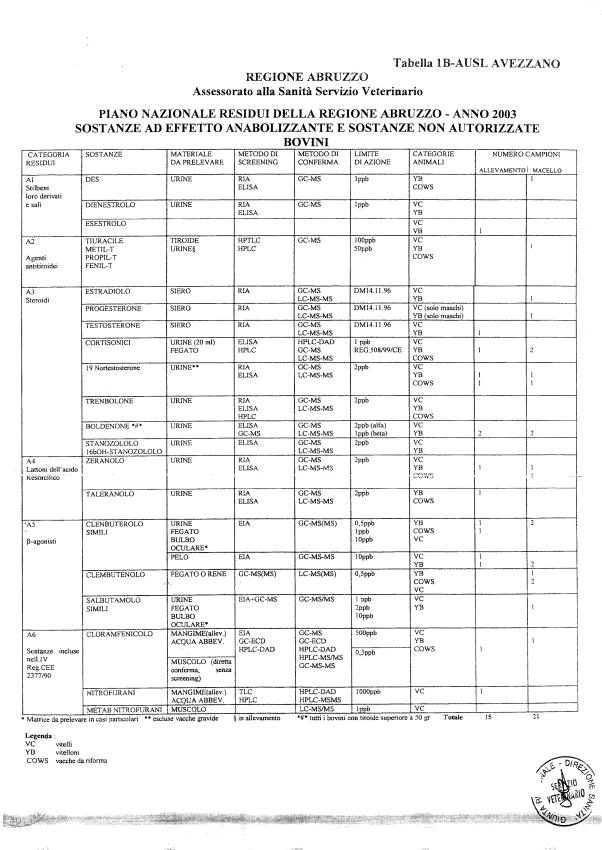
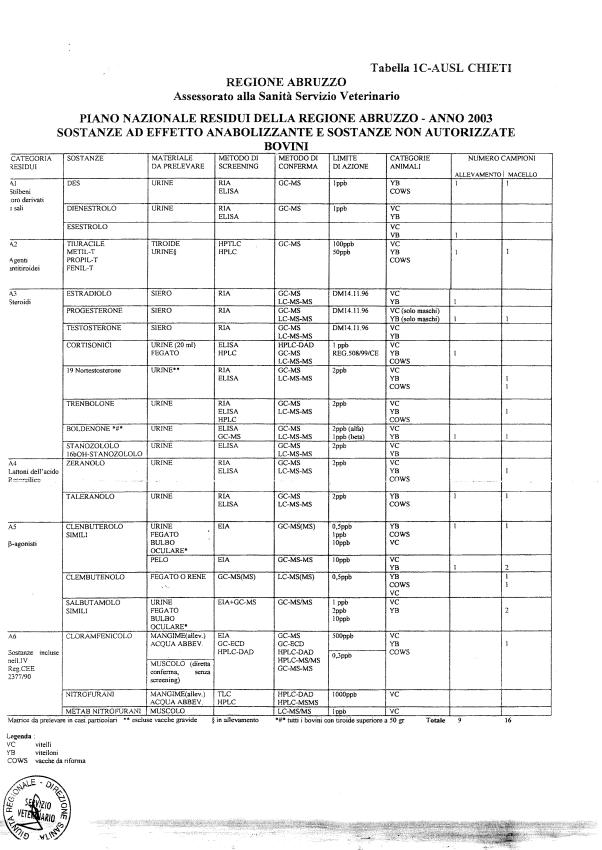
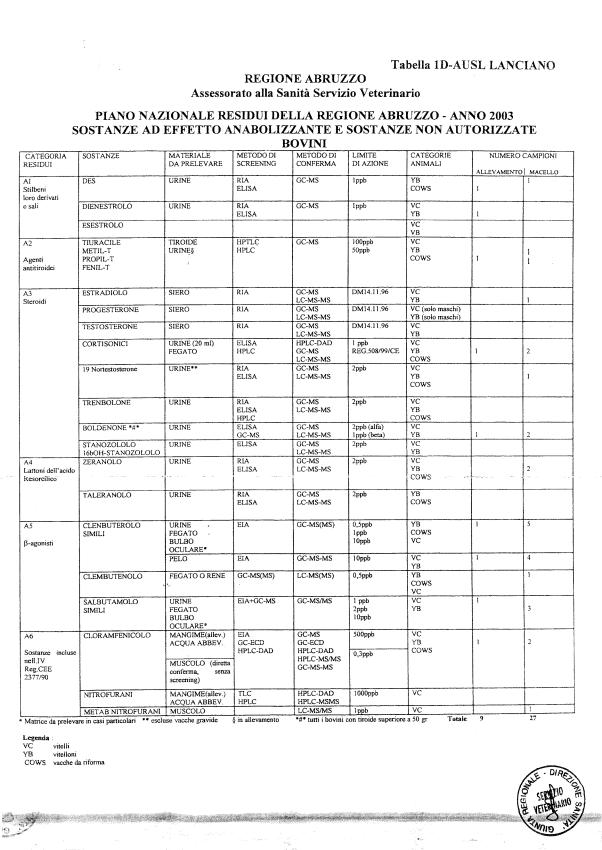
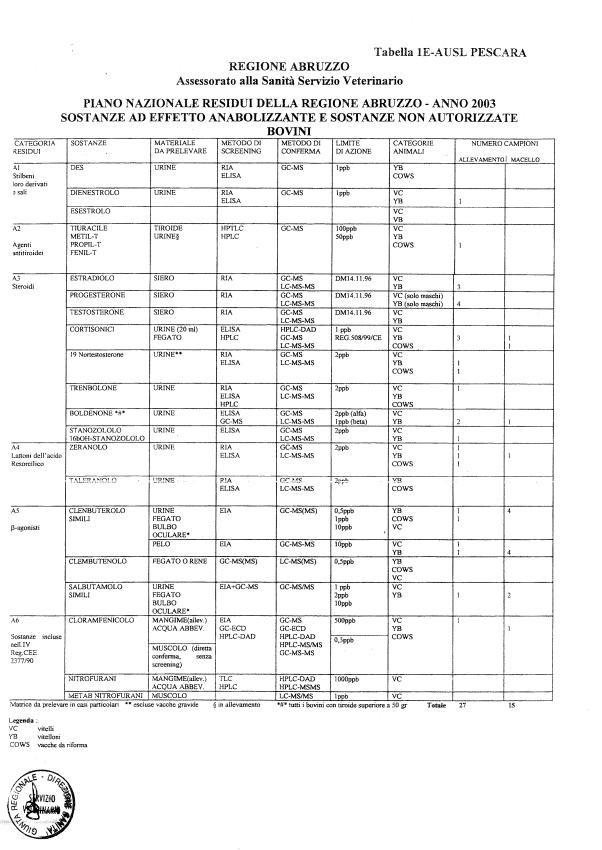
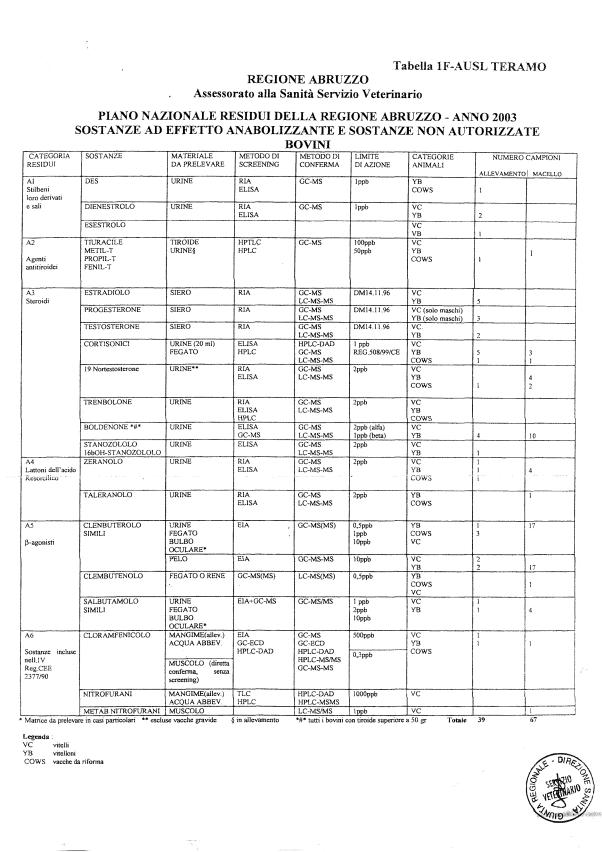
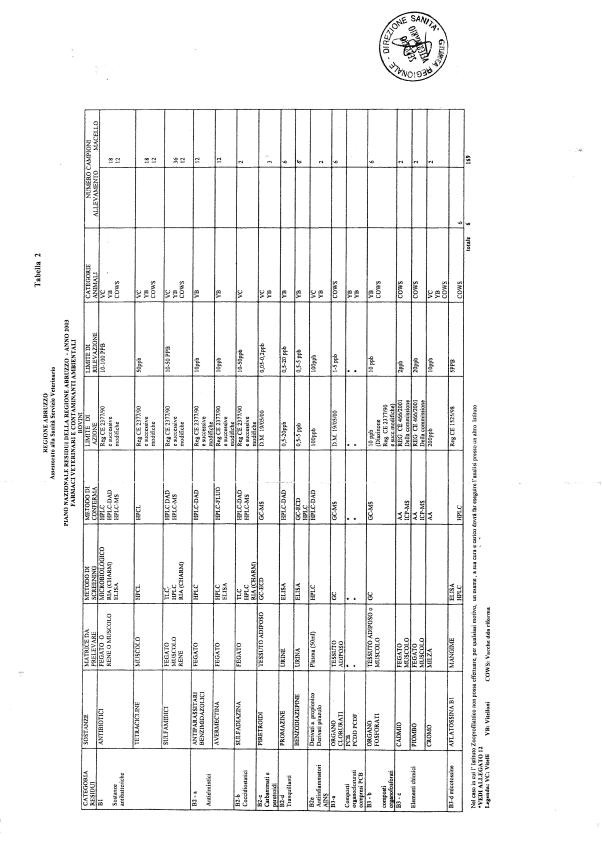
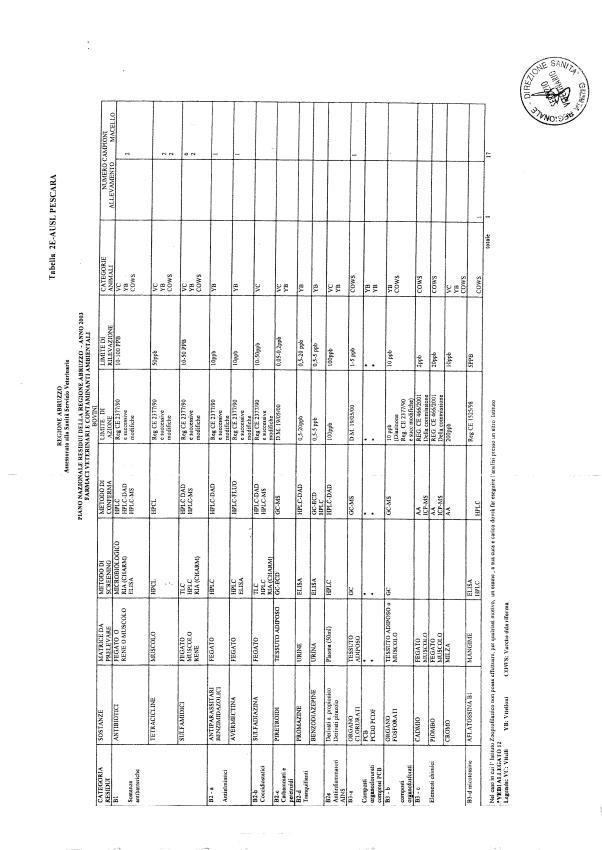
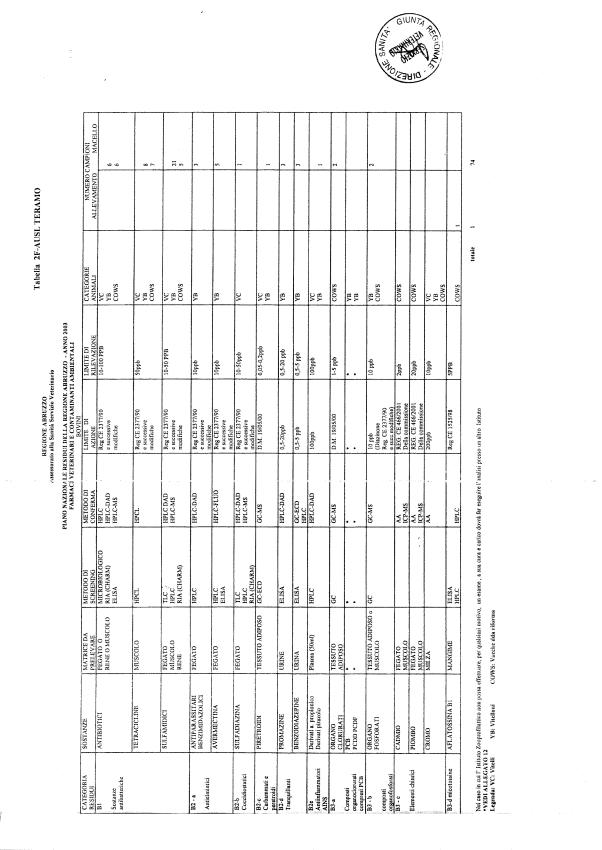
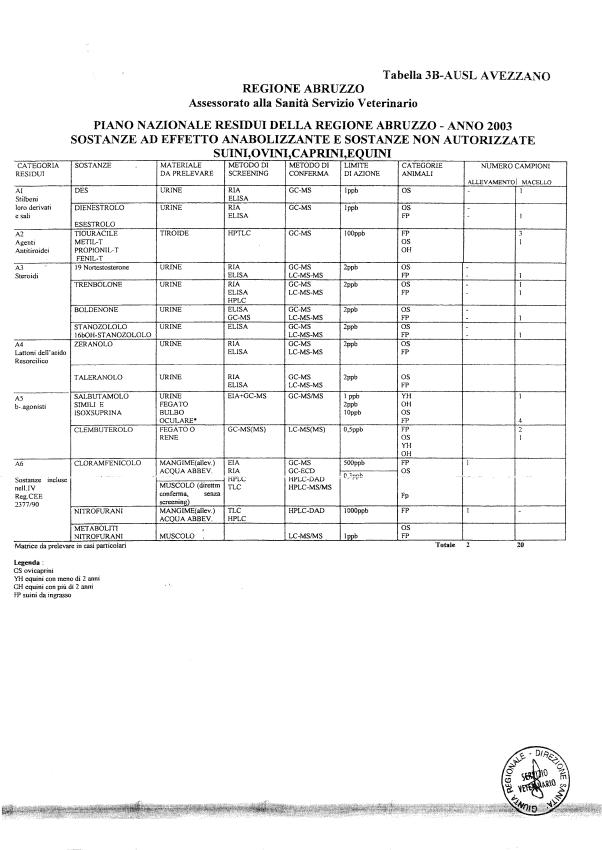
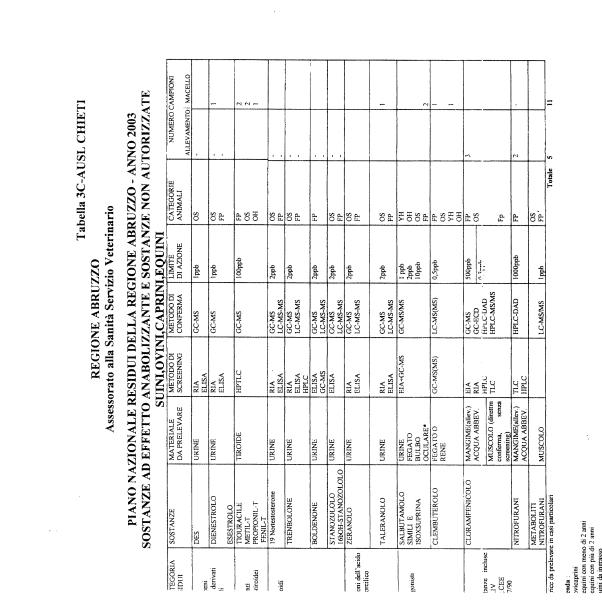
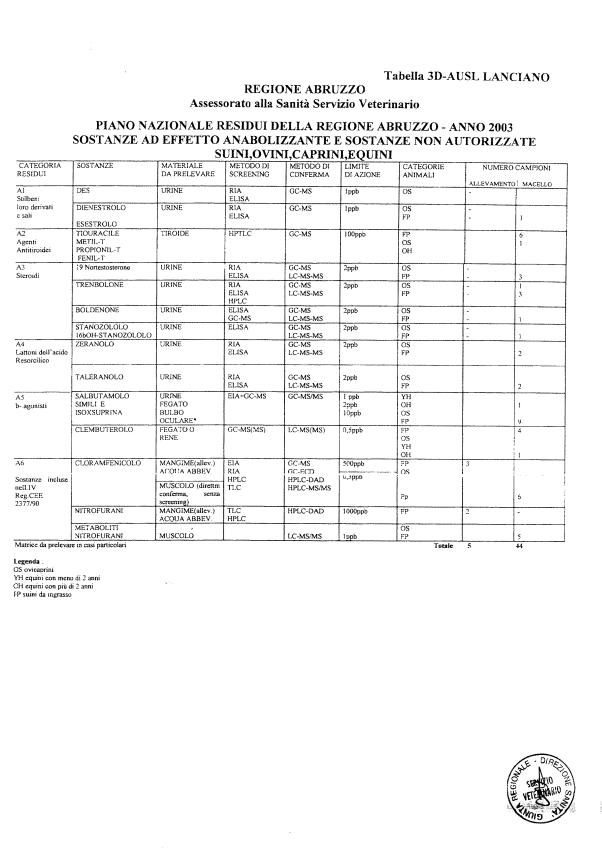
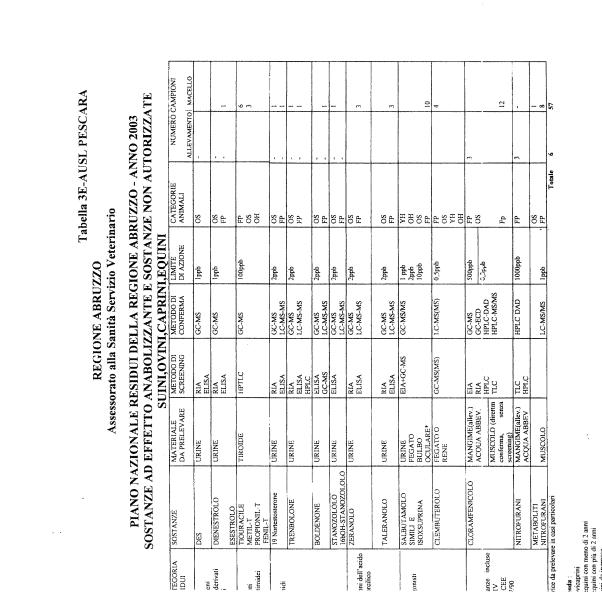
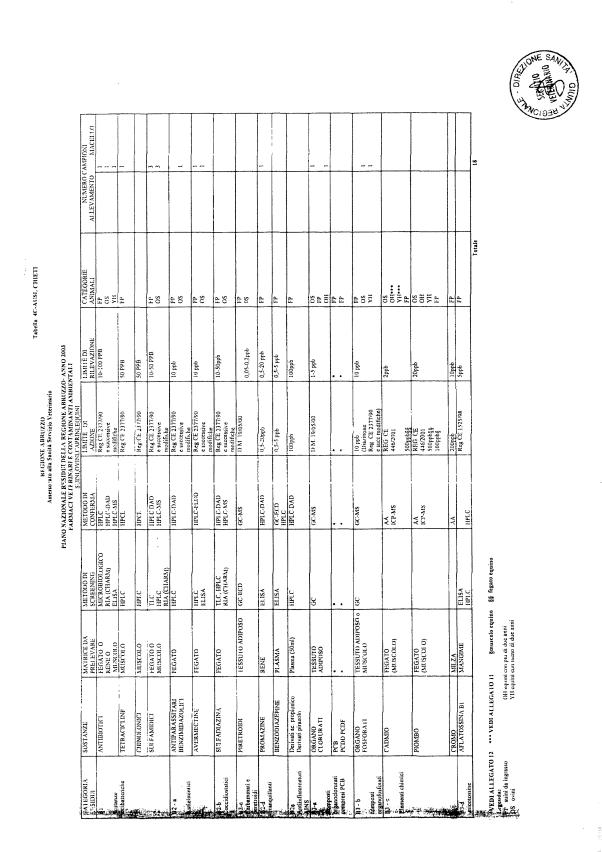
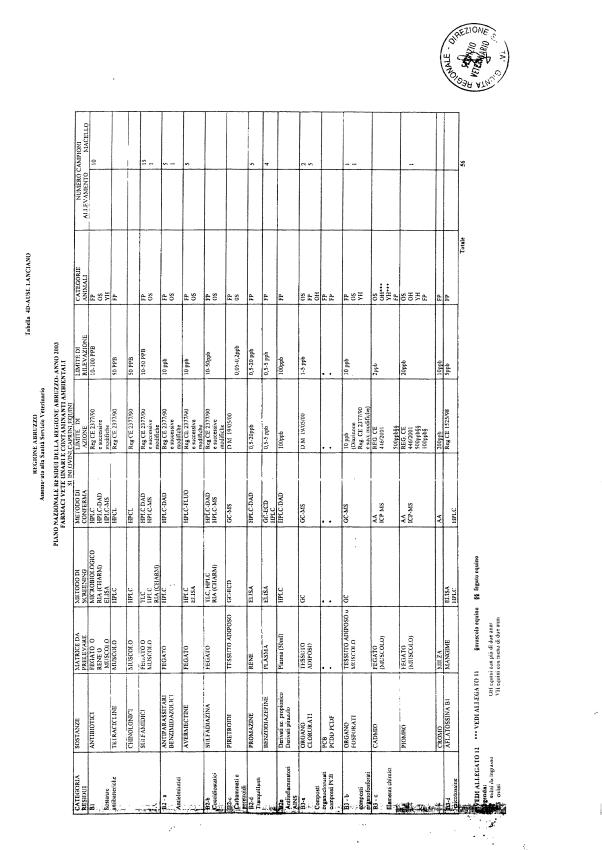
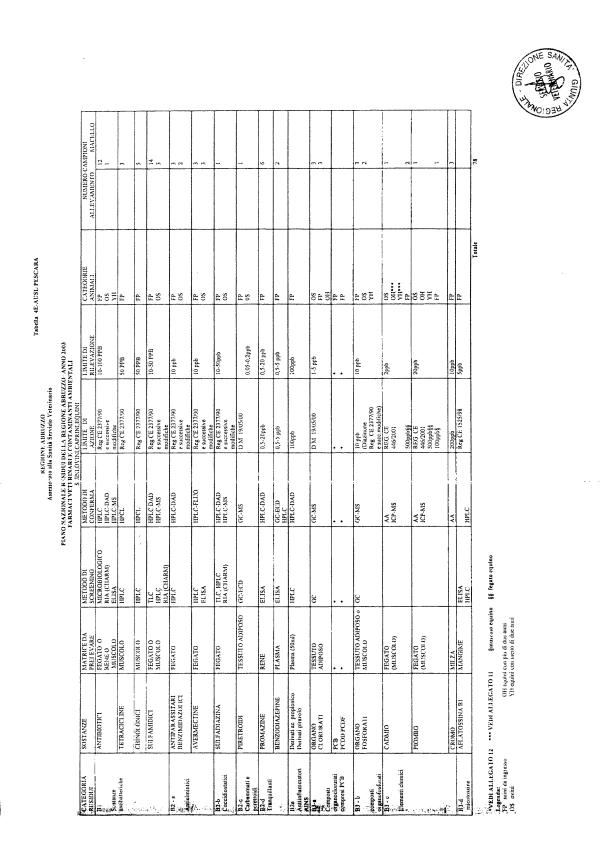
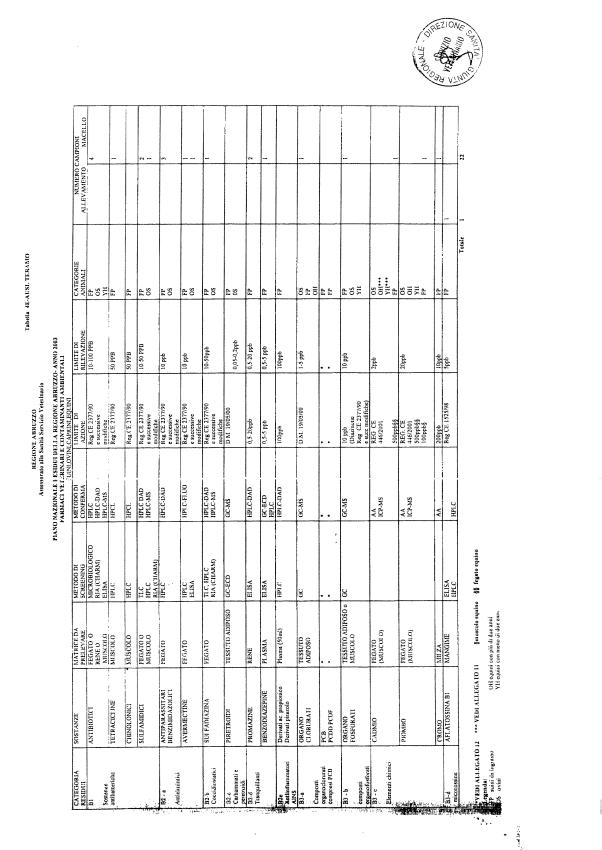
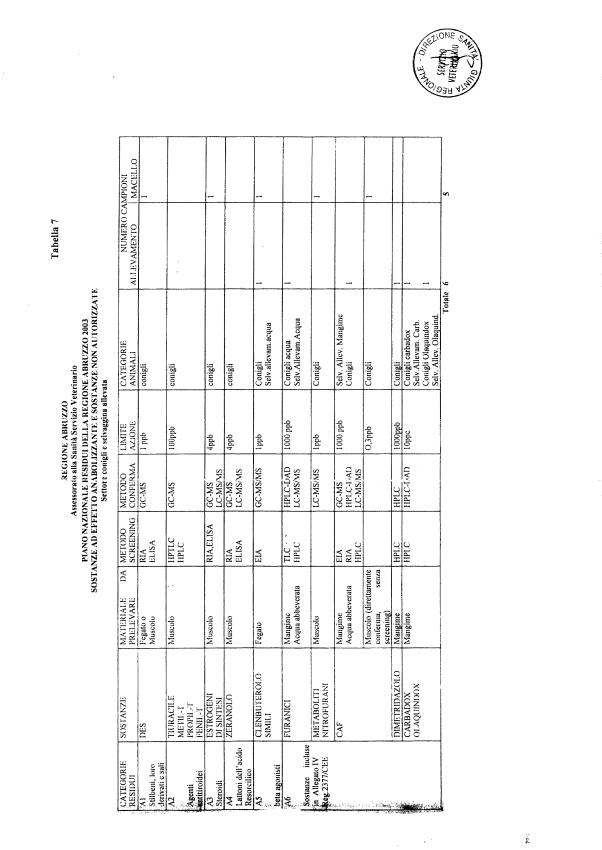
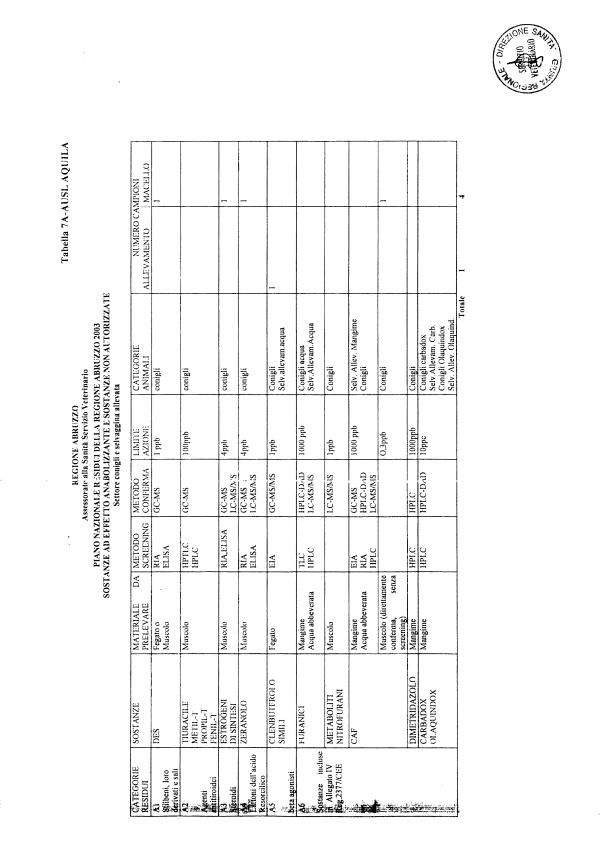
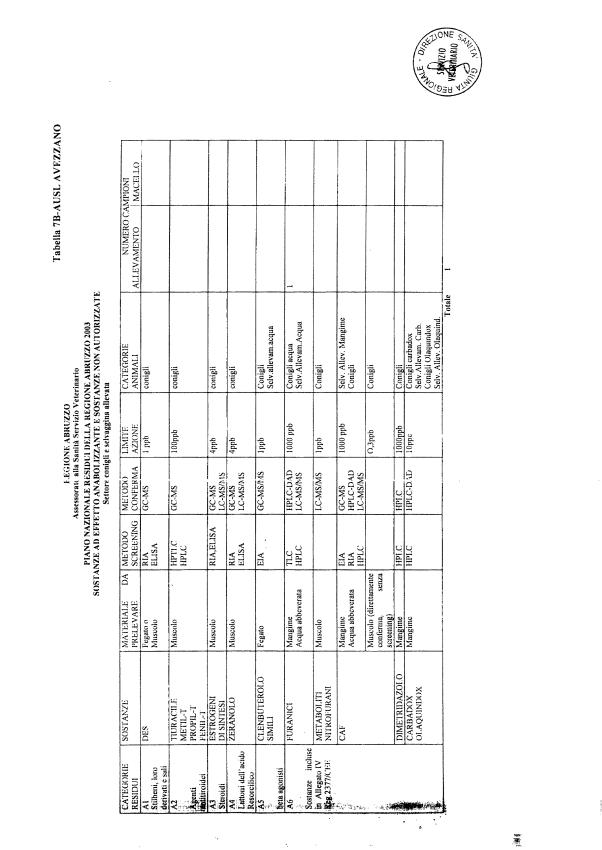
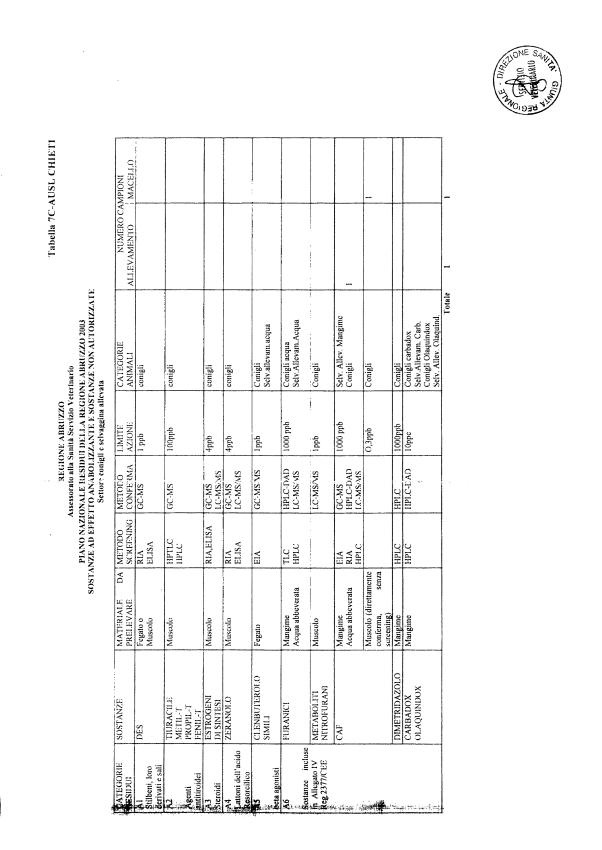
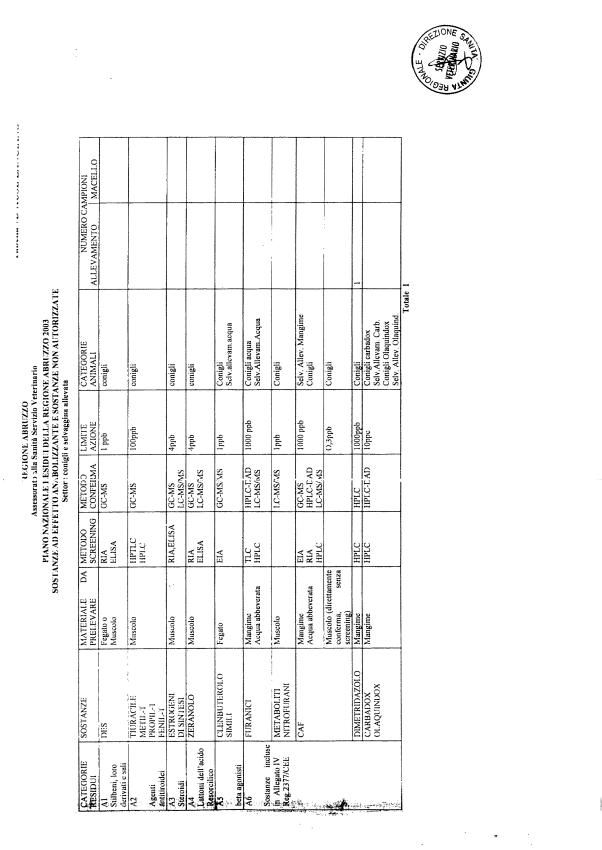
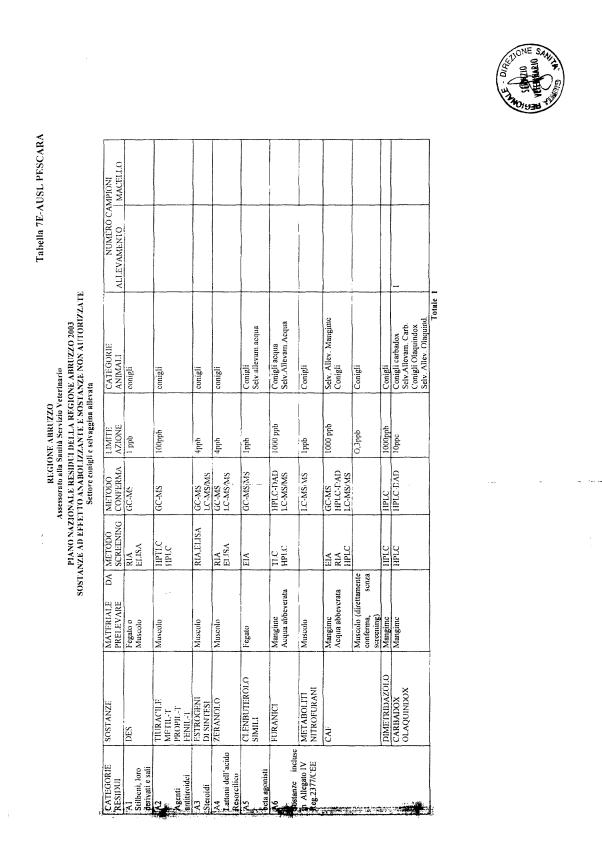
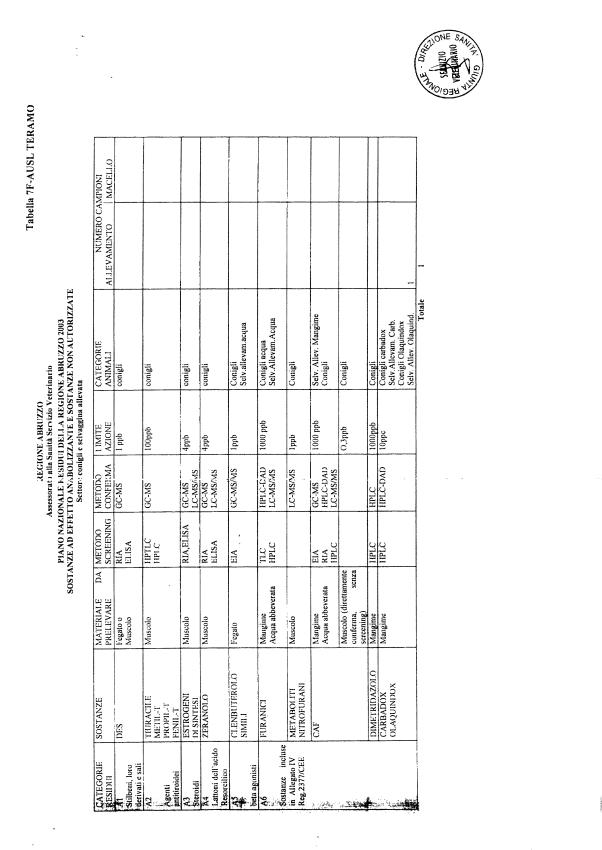
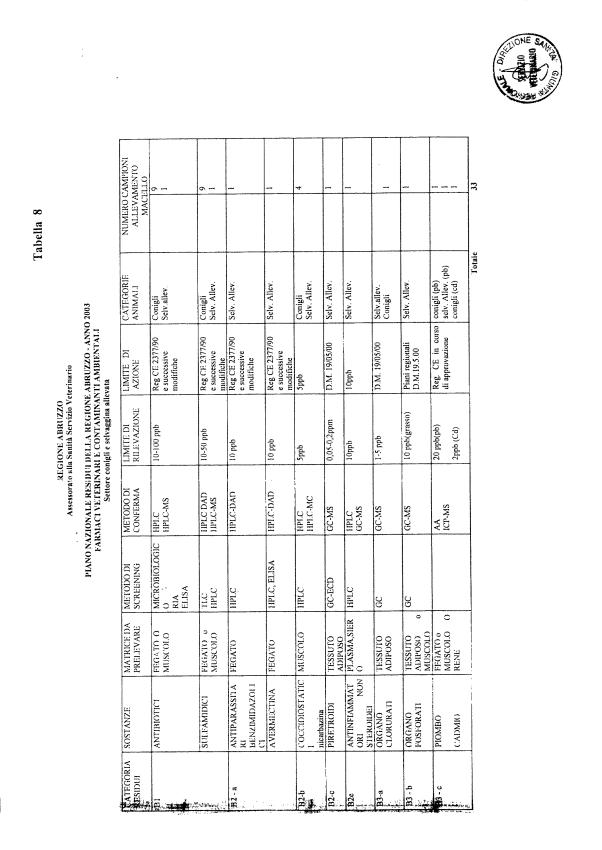
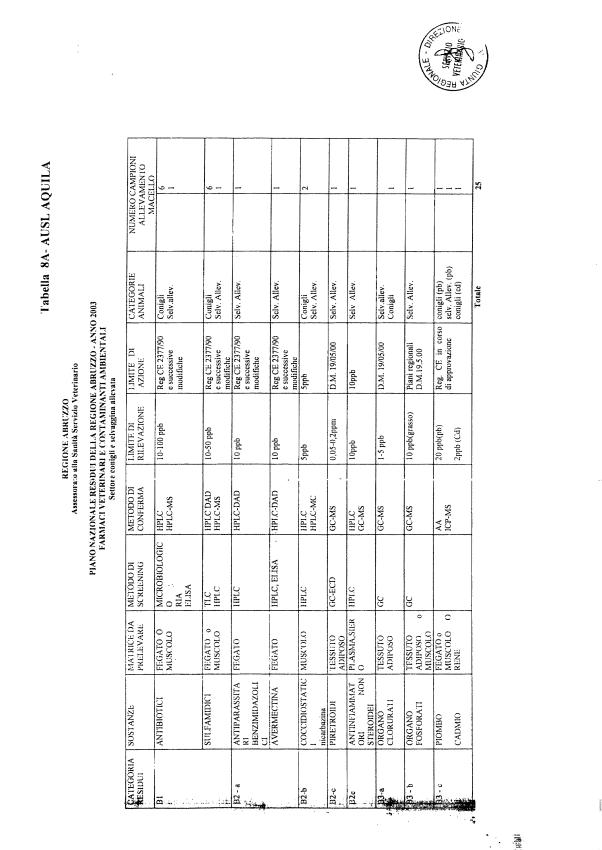
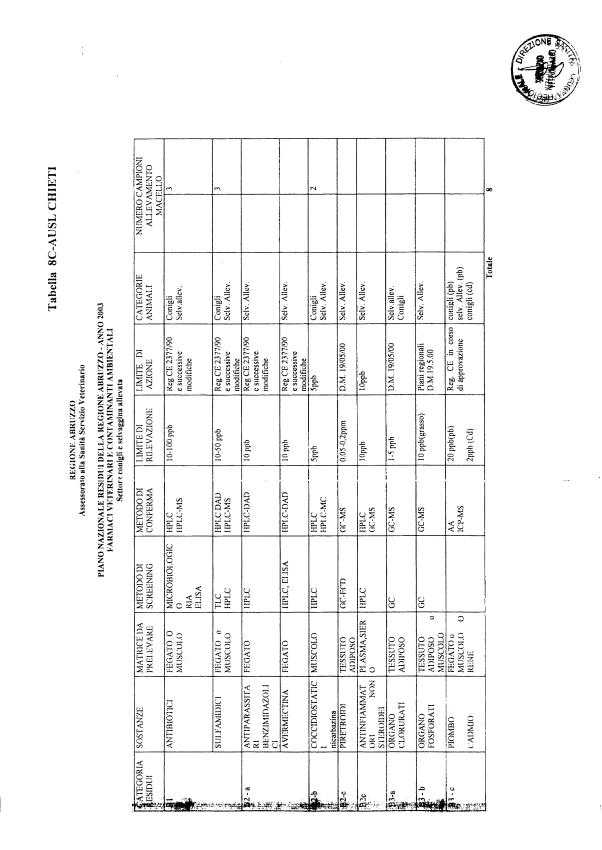
Le tabelle n. 1-13 e gli allegati 11 e 12 riportano le sostanze da ricercare, le matrici da prelevare, i metodi di screening e di conferma, il limite di rilevabilità o il limite d’azione. Tali indicazioni potrebbero essere soggette a modifiche in corso di applicazione del PNR a seguito di decisioni comunitarie o acquisizione di nuove conoscenze tecnico-scientifiche.
Per le sostanze con un limite di legge o con
un limite massimo di residuo il limite d'azione è rappresentato da tali
valori.
Per le sostanze non autorizzate, il limite di rilevabilità riportato in tabella è la concentrazione minima che tutti i laboratori devono essere in grado di evidenziare per poter procedere alle analisi richieste. Comunque, qualsiasi riscontro di sostanze non autorizzate, anche se evidenziate a concentrazioni inferiori a quelle riportate in tabella, deve essere interpretato come positività.
Per le sostanze per cui è indicato un metodo di conferma, in caso di positività con un metodo di screening è necessario procedere all'analisi di conferma.
Per le sostanze della categoria A (all. 1 del D.Lgs. 336/1999), in attesa dell'approvazione dei metodi di riferimento da parte dei LCR, possono essere impiegati per l'analisi di conferma metodi basati sulla spettrometria molecolare (es GC-MS, HPLC-MS-MS) o spettrofotometria per assorbimento, conformi ai criteri tecnici per l’identificazione e determinazione dei residui previsti al punto 2 dell'allegato alla Decisione 93/256/CEE.
Qualora un laboratorio temporaneamente non possa effettuare l'analisi di conferma, quest'ultima sarà eseguita presso un altro IZS o altro laboratorio individuato dal Ministero della Sanità .
Nell'ambito del PNR possono essere adottati altri metodi per l'analisi di screening e di conferma (es. LC-MS, LC-MS-MS), purchè i parametri di tali metodi siano confrontabili con quelli previsti dal PNR e comunque siano compatibili con i limiti d'azione. Nel caso in cui vengano adottati metodi LC-MS-MS i criteri per l’identificazione degli analiti sono revisionati in funzione della specificità di questa tecnica.
Per i metodi multiresiduo sono stati riportati gli intervalli dei limiti di rivelazione.
Per gli antibiotici la positività non può essere comunque segnalata sulla base della combinazione di due metodi di screening. Va precisato che il metodo di screening non ha validità legale; per l'azione legale, nel caso di antibiotici con LMR, devono comunque essere adottati sia i metodi di screening che i metodi di conferma.
I metodi di screening adottati per gli antibiotici devono comunque avere limiti di rivelazione inferiori ai limiti massimi di residuo consentiti per tali sostanze.
In caso di contenzioso internazionale o di revisione di analisi la ricerca di tutte le sostanze di cui all’allegato 1 del D.Lgs. 336/1999 sarà effettuata presso il LNR con metodi di riferimento basati su tecniche di spettrometria molecolari o, in assenza di tali metodi, comunque con tecniche di spettrometria molecolari.
In caso di riscontro di positività si applicano le procedure descritte negli articoli da 21 a 26 del D.L.vo 4 agosto 1999.
Nel caso di sospetto o di conferma di trattamento illecito devono essere avviate indagini nell'allevamento di provenienza degli animali e negli allevamenti funzionalmente o amministrativamente collegati (art. 18.1b).
Qualora si constati un trattamento illecito (Art 22) si dispone inoltre il sequestro degli allevamenti sottoposti alle indagini e si procede al prelievo di campioni ufficiali su una percentuale significativa di animali appartenenti allo stesso gruppo o ad altro gruppo nella fase riproduttiva più prossima a quella dell'animale risultato positivo applicando la tabella riportata in allegato 17.
Se è confermato il trattamento illecito con positività di almeno la metà dei campioni devono essere abbattuti tutti gli animali sospetti presenti in azienda (Art.25.3).
Per un periodo successivo di almeno dodici mesi l'azienda o le aziende appartenenti al medesimo proprietario saranno sottoposte ad un controllo più rigoroso per la ricerca dei residui (Art. 25.4).
Controlli ufficiali supplementari per rivelare l'origine della sostanza oggetto di positività devono altresì essere disposti nelle aziende o negli stabilimenti (produttori di farmaci, di mangimi, ecc.) che riforniscono l'azienda interessata nonché in tutte le aziende e stabilimenti appartenenti alla stessa catena di fornitori di animali e di alimenti per animali.
In caso di superamento dei limiti massimi di residui (art 23) deve essere effettuata un'indagine nell'azienda di origine per stabilire le cause di tale superamento e, ai sensi di tale indagine, devono essere prese tutte le misure a tutela della salute pubblica.
In caso di infrazioni ripetute al rispetto dei limiti massimi di residui, il Servizio Veterinario assicurerà un controllo più rigoroso degli animali e dei prodotti dell'azienda e/o dello stabilimento in questione e di quelli funzionalmente collegati per un periodo di almeno sei mesi con sequestro dei prodotti o delle carcasse in attesa dei risultati delle analisi.
A seguito del riscontro di positività per tutte le sostanze della categoria A e per i farmaci veterinari, deve essere effettuata un'accurata indagine epidemiologica con la compilazione della scheda di cui all’allegato 18.
Tutte le schede vanno inviate sia alla
Regione/Provincia autonoma competente per territorio che all'Osservatorio per
l'Epidemiologia Veterinaria (COVEPI) istituito presso l'IZS di Teramo che ha
preparato e distribuito a tutte le Regioni e Province autonome un programma
computerizzato per l'archiviazione delle indagini epidemiologiche .
4.
PROGRAMMAZIONE 2003
Per l'anno in corso sono previsti 1426 campioni in totale di cui:
- 848 per le specie bovina, suina, ovi-caprina;
- 11 per la specie equina;
- 408 per il settore avi-cunicolo e la selvaggina;
- 66 per il settore acquacoltura;
- 42per il latte (Bovino, bufalino e ovino)
- 26 per le uova
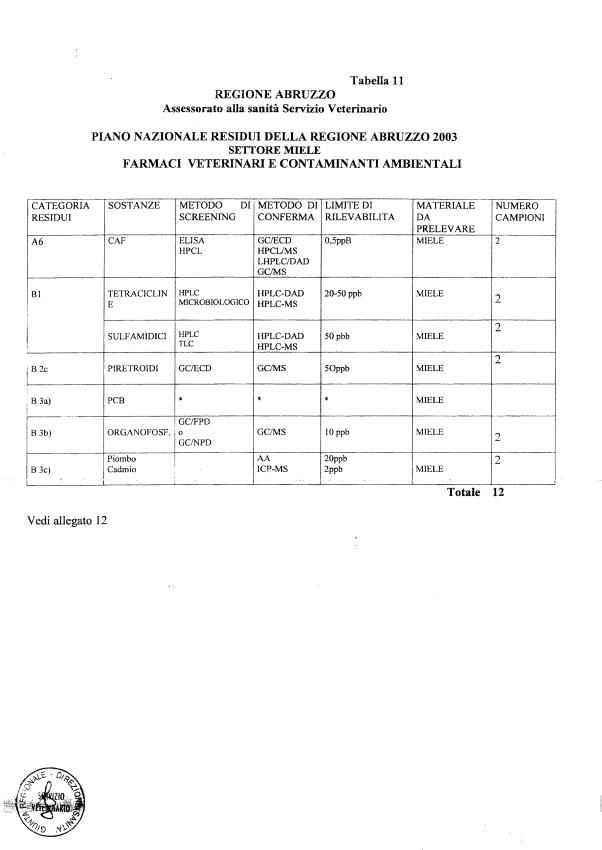
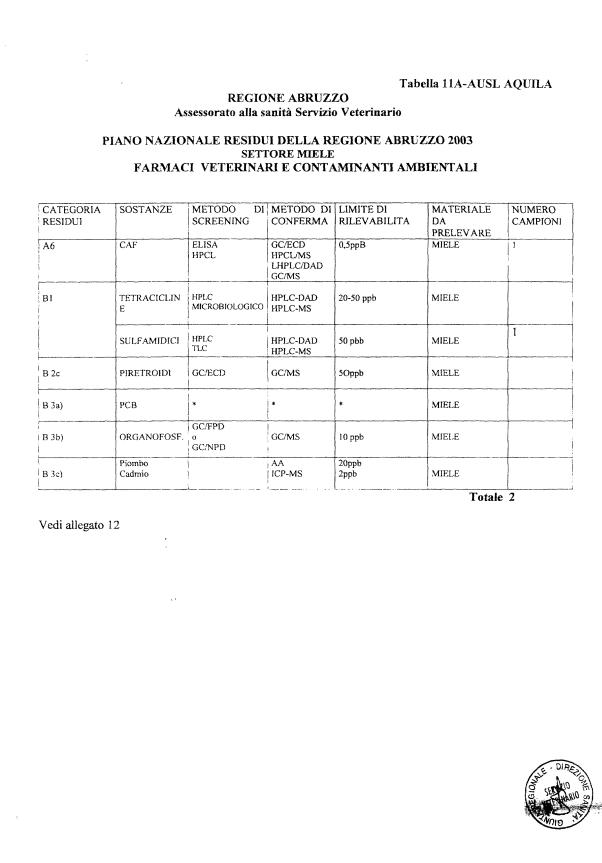
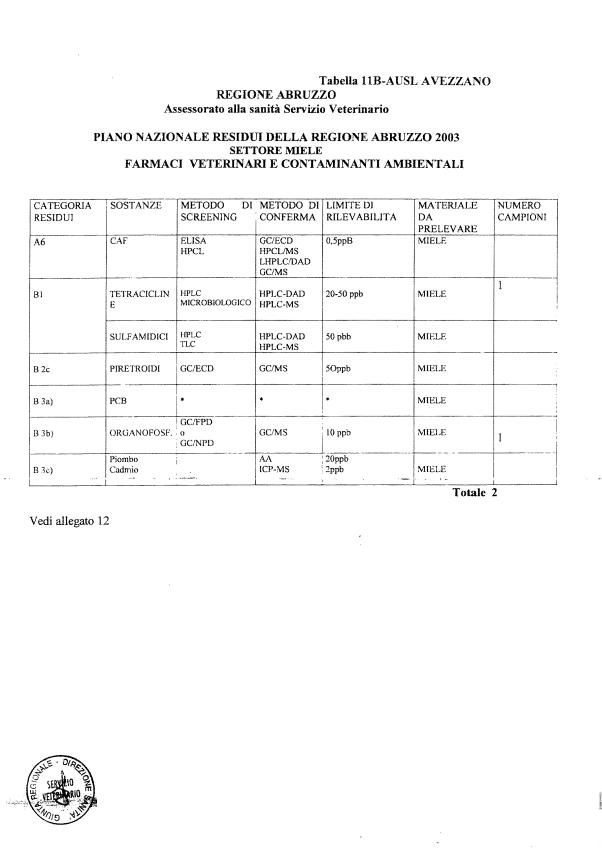
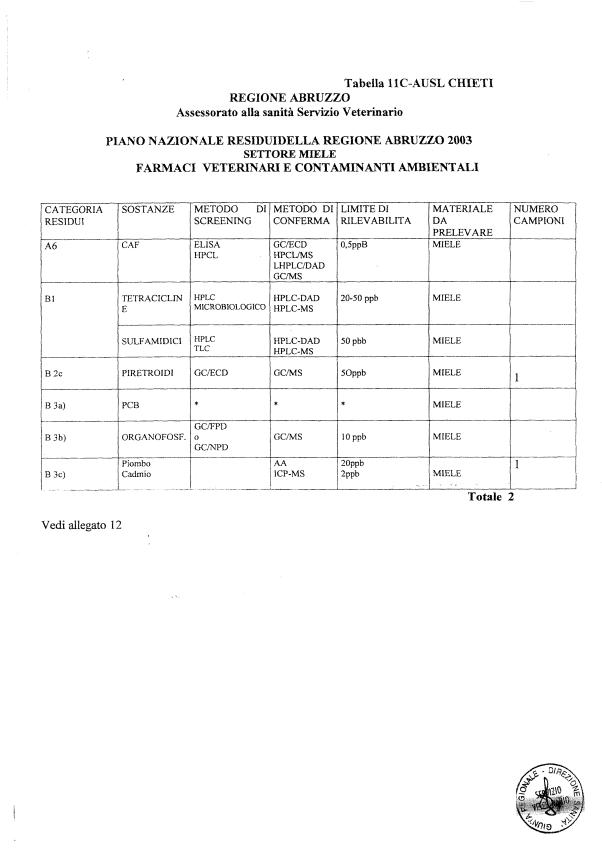
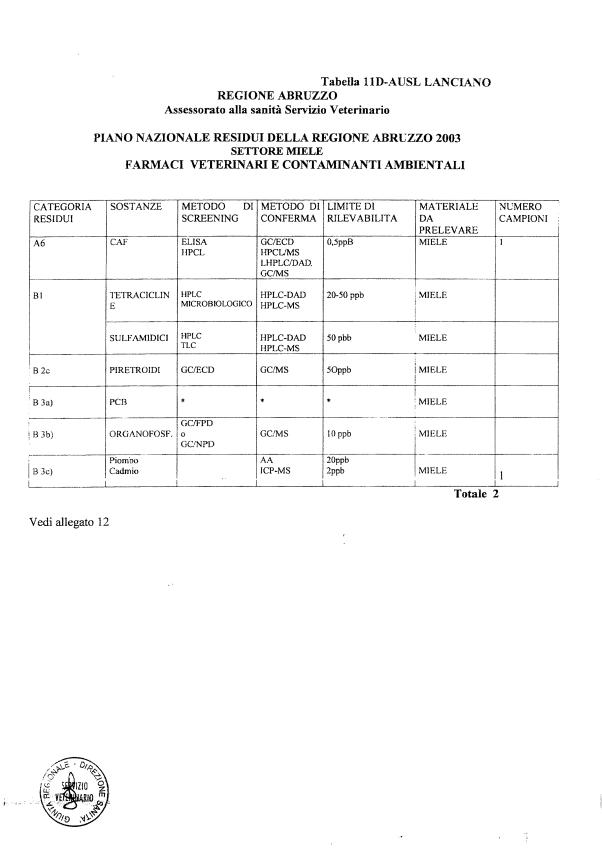
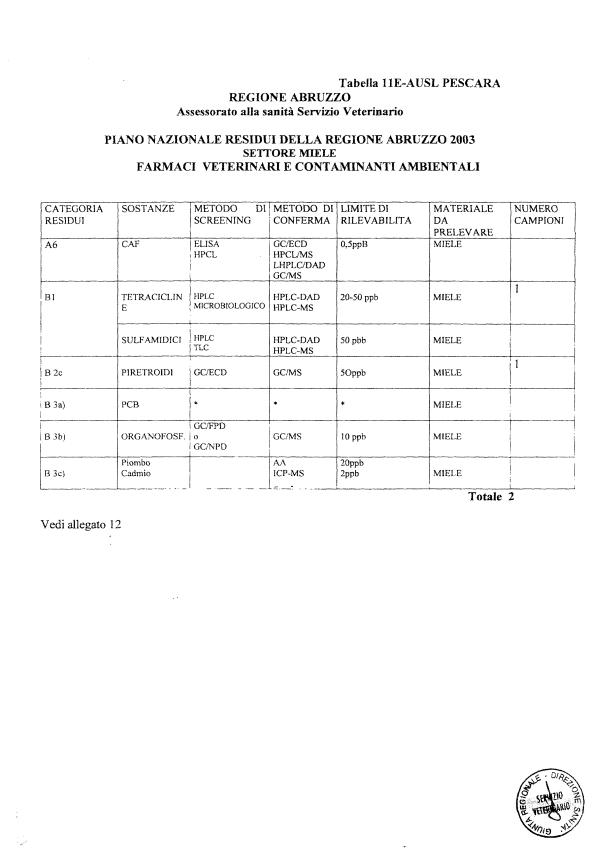
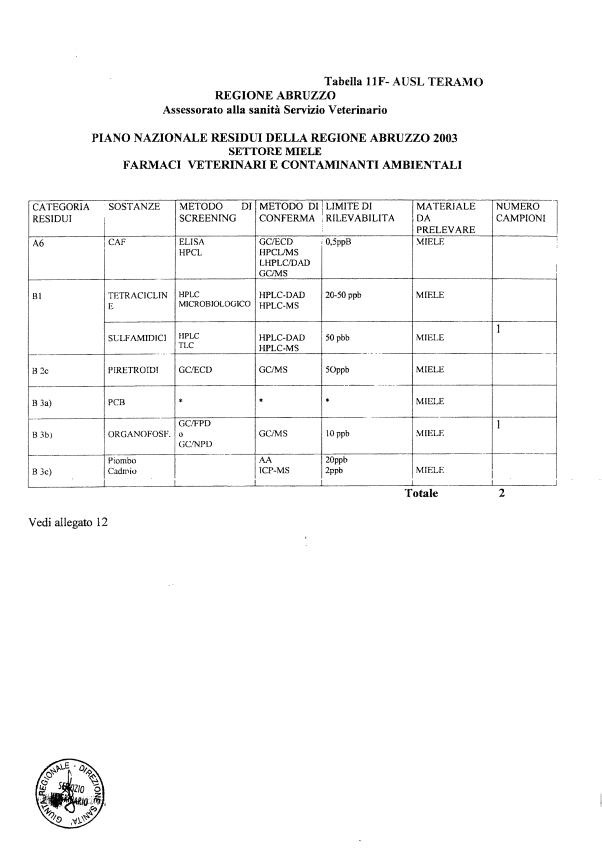
- 13 per il miele
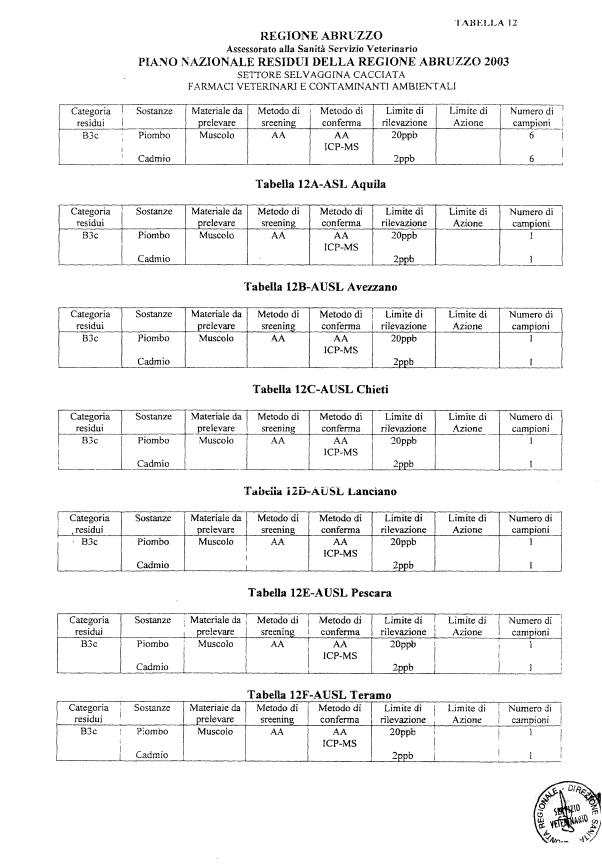
- 12 per la selvaggina cacciata
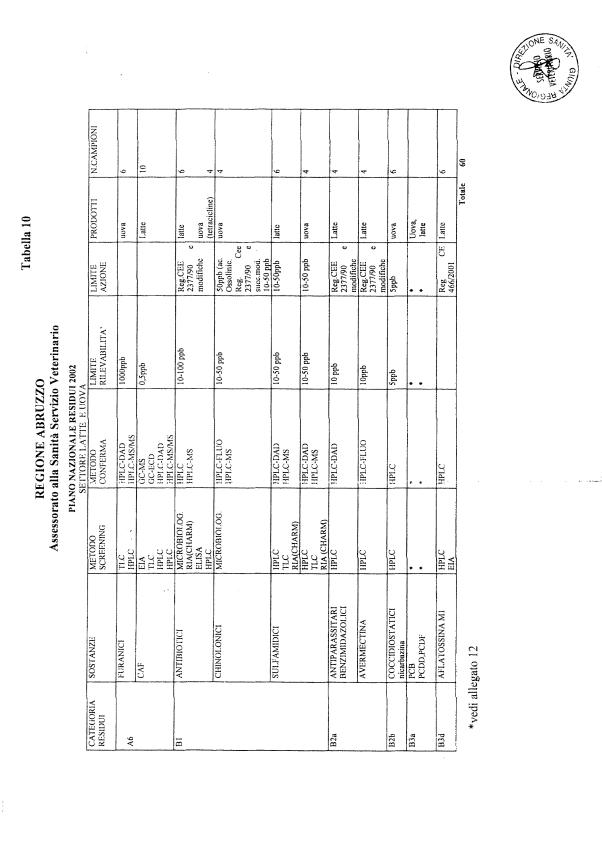
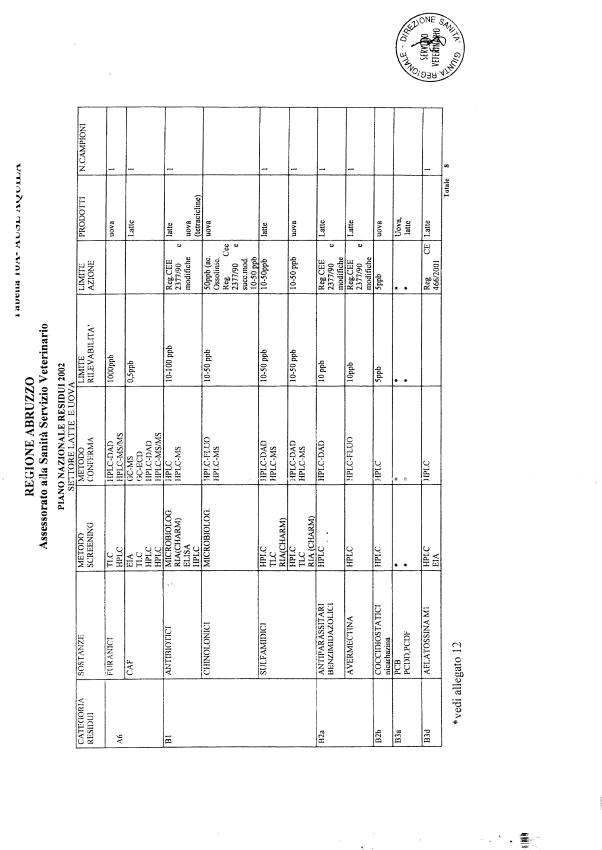
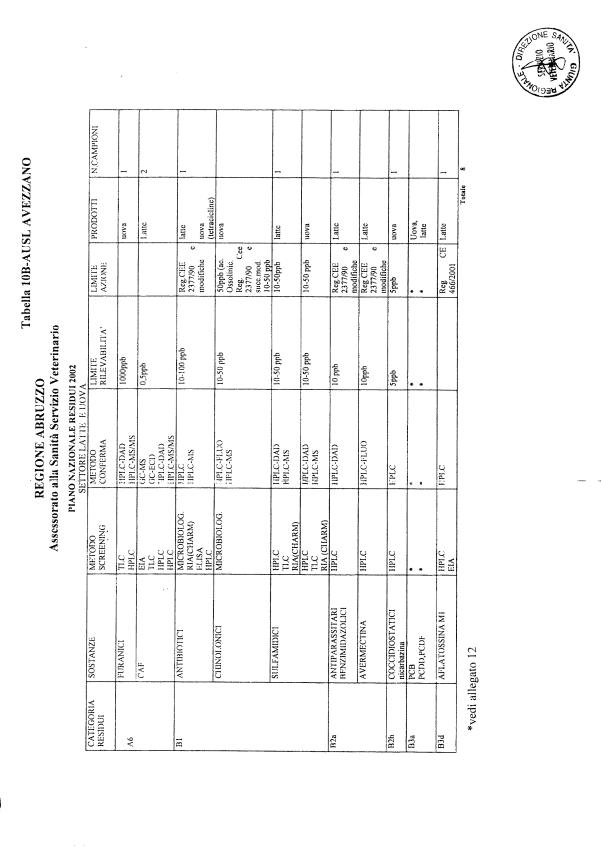
La programmazione specifica per ogni tipo di residuo è riportata nelle tabelle 1-12 e negli allegati 11 e 12.
Si raccomanda di sottoporre a congelamento
rapido i campioni onde evitare la degradazione delle sostanze.
Istituto
Zooprofilattico Sperimentale “G.Caporale”
L’ IZS deve dare comunicazione immediata di ogni positività riscontrata allo scrivente Servizio Veterinario Regionale e alla Direzione Generale Sanità Pubblica Veterinaria Alimenti e Nutrizione del Ministero della Salute , tramite telegramma, fax o e-mail.
Presso l'IZS è attivo il Centro Epidemiologico Veterinario, questo dovrà collaborare con la Regione per l'elaborazione ed invio periodico dei dati.
L'IZS dovrà inoltre inviare semestralmente, entro il 15/7/2003 ed entro il 15/01/2004, i dati all'Assessorato regionale alla sanità su supporto magnetico in modo da consentirne, previa verifica, la successiva trasmissione al Ministero della Salute, Direzione Generale Sanità Pubblica Veterinaria Alimenti e Nutrizione, Ufficio IX .
Per i contaminanti ambientali, l’ IZS dovrà indicare i singoli valori delle analisi effettuate ed eventuali limiti di legge.
Inoltre in caso di non conformità, per campioni per i quali è richiesta la ricerca di una categoria di sostanze (es. organofosforati, cortisonici ecc.), l’ IZS specificherà la singola molecola indicandone la quantità rilevata.
Entro il 31/7/2003 la Regione provvede ad inviare alla Direzione Generale Sanità Pubblica Veterinaria Alimenti e Nutrizione del Ministero della Salute i dati relativi al primo semestre ed entro e non oltre il 31/1/2004 i dati completi per l'intero anno di attività.
Gli allegati 1-9 verranno utilizzati per la raccolta dei dati .
L'allegato 10 si riferisce ai soli allevamenti bovini. In esso verranno indicati il n. di allevamenti presenti nel territorio regionale, il n. di allevamenti controllati per ormoni e beta- agonisti ed il n. di allevamenti positivi specificando la sostanza causa della positività.
Le informazioni comprese in questo allegato sono particolarmente importanti in quanto il riscontro di un animale positivo lascia supporre il trattamento di tutto l'effettivo o di tutto il gruppo di animali.
Negli allegati 1A, 2A,...10A, devono essere riportati rispettivamente gli stessi dati sopra menzionati concernenti i campionamenti effettuati a seguito di piani regionali o di vigilanza da parte della AUSL (Extra-Piano).
Per rispondere alle richieste della Commissione Europea gli allegati 1B, 2B...10B raccolgono i dati relativi ai campionamenti su sospetto.
La Regione trasmette annualmente
all'AGEA l'elenco dei codici aziendali
degli allevamenti bovini risultati positivi.
Aziende
Unità Sanitarie Locali
Le AUSL devono dare comunicazione immediata
alla Regione e al Ministero dellaSalute
di ogni positività, curando che siano specificati i dati identificativi
del referto analitico. La comunicazione di positività deve essere corredata
dall'indagine epidemiologica, effettuata utilizzando l'allegato 18 in caso di
sostanze ormonali e beta- agoniste.
L'invio tempestivo dei dati permetterà un
miglior coordinamento e un più efficace svolgimento del PNR.
Istituto
Superiore di Sanità
L'Istituto Superiore di Sanità provvederà a diramare l'elenco dei propri referenti per la ricerca delle singole molecole del PNR.
Le operazioni di campionamento relative al presente Piano 2003 dovranno improrogabilmente concludersi entro il 15.12.2003.
Per qualsiasi
informazione o chiarimento rivolgersi:
Assessorato Sanità
Servizio Veterinario
Dr. Sabatino Mastropietro
Tel.
0857672656
Fax 0857672637
s.mastropietro@regione.abruzzo.it























ALLEGATO 14
COMPITI DEI
REFERENTI AUSL PER IL PNR
Il PNR, per
funzionare al meglio, necessita di personale qualificato, all'altezza dei
compiti assegnati. Il referente AUSL per il PNR assume un ruolo che presuppone
conoscenze non solo in materia veterinaria, ma anche in altri campi, quali:
- conoscenza degli adempimenti previsti dal PNR;
- conoscenza degli adempimenti legati alla gestione del
- contenzioso amministrativo e penale;
- conoscenze approfondite sugli effetti delle sostanze
usate illegalmente come promotori di crescita negli
animali da carne.
1. Conoscenza degli adempimenti previsti dal PNR
Il referente del PNR sovraintende a tutte le attività collegate alla pratica attuazione dei piani di monitoraggio predisposti a livello regionale. Egli tiene conto delle indicazioni fornite dal NORV, dal coordinatore del Servizio Veterinario e dei suggerimenti degli altri referenti di area funzionale.
Deve conoscere in dettaglio le procedure previste per la corretta esecuzione dei programmi di controllo con particolare riguardo alle modalità operative, alle buone pratiche di campionamento, ed all'aggregazione dei dati di attività. Verifica in ultimo la regolare esecuzione dei piani di lavoro affidati ai singoli operatori ed i risultati ottenuti.
L'opera del referente del PNR non deve comunque limitarsi a compiti meramente organizzativi; egli deve farsi anche parte attiva nell'assumere il maggior numero di informazioni sulla presenza di residui ed in particolare su possibili attività illecite legate all'uso di sostanze vietate nel territorio di competenza. Il continuo scambio di notizie tra NORV e referenti del PNR permetterà l'acquisizione di utili elementi di giudizio da utilizzare nell'attività del PNR.
2. Conoscenze legate alla gestione del contenzioso amministrativo e penale
In caso di esiti positivi ai controlli, scatta la contestazione agli interessati delle violazioni di legge. Il referente del PNR deve pertanto possedere sufficienti nozioni in materia di contenzioso amministrativo e penale in grado di guidarlo nei procedimenti sanzionatori.
Al riguardo si ritiene estremamente importante sottolineare come finora questa materia sia stata sottovalutata da alcuni operatori del Servizio Sanitario Nazionale. Occorre pertanto una presa di coscienza sulle mutate esigenze organizzative della sanità pubblica veterinaria. La contestazione del reato o della violazione di legge avvia in effetti un lungo contradditorio tra le parti il cui esito dipende in larga misura dall'impegno e dalle attenzioni dedicate, dagli Organi accertatori, ai singoli episodi. Spesso, in passato, con l'emissione del verbale di sanzione o con la denuncia all'Autorità Giudiziaria delle violazioni di legge, si è pensato di aver assolto compiutamente ai propri doveri. L'esperienza insegna al contrario l'estrema importanza di un costante rapporto tra Organi accertatori ed Organi inquirenti.
Ai referenti del PNR viene pertanto chiesto di avviare stretti rapporti di collaborazione con gli uffici amministrativi e con le Procure interessate al problema.
3. Conoscenze approfondite sugli effetti delle sostanze anabolizzanti negli animali da carne
E' noto come l'impiego illecito di promotori di crescita nel settore zootecnico possa indurre evidenti modificazioni, anche anatomiche, negli animali trattati. Il referente del PNR ed i suoi collaboratori devono utilizzare queste conoscenze per ottimizzare l'attivita` di vigilanza presso gli allevamenti ed i macelli. In allegato 15 sono riportate alcune prove istologiche, indicate dall'Istituto Superiore di Sanità, da eseguire negli animali macellati. Attente verifiche post-mortem possono costituire utili elementi di giudizio ai fini di un'efficace e qualificata attività di controllo.
Il referente del PNR non potrà inoltre dimenticare, nella programmazione degli interventi, di assicurare un maggior controllo in quelle aziende già segnalate per precedenti positività.
ALLEGATO 13
REGIONE
ABRUZZO
ASL n°. . . . . . . . . Distretto
. . . . . . . . . .
Verbale di prelievo n°: . . . . . . . . . .
![]()
![]()
![]() PNR Extra-PNR Su SOSPETTO
PNR Extra-PNR Su SOSPETTO
![]()
![]() Tipo di
prelievo: casuale casuale
mirato
Tipo di
prelievo: casuale casuale
mirato
In data: ………………………alle ore: …………il/i
sottoscritto/i verbalizzante/i . . . . . . . . . . . . . . . . . . . . . . . .
. . con la qualifica di . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . si sono recati presso :
![]() Ditta/Macello
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .con sede a . . . . . . . . . . . . . . . prov. . . . .
. . . . . via/fraz. . . . . . . . .
. . . . . . . . . . . . . . . . . .ASL . . . . . . .
Ditta/Macello
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .con sede a . . . . . . . . . . . . . . . prov. . . . .
. . . . . via/fraz. . . . . . . . .
. . . . . . . . . . . . . . . . . .ASL . . . . . . .
![]() Az. Agr./Allevamento . . . . . . . . . . . . . . . . . . . . . N° Codice
Az. Agr./Allevamento . . . . . . . . . . . . . . . . . . . . . N° Codice
con sede in . . . . . . . .
. . . . . . .via/fraz. . . . . . . . . . . . . . . . . . . . . . . . . . .ASL .
. . . . . .
e alla presenza del Sig. . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . nato a . . . . . . . . . . . .
. . . . . . . . . . . . . . . .
.........................................................................................................
Il. . . . . . . . . . . . . . . . in qualità
di . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . preso atto che i capi:
specie: . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . categoria/età: . .
. . . . . . . . . . . . . . . . . . .
razza: . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . sesso: . . . . . .
. . . . . . . . . . . . . . . . .
numero MA o tatuaggio: . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
......................................................................
sono di proprietà di: . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . nato a: . . . . . . . . . . . . . .
. . . . . il: . . . . . . . . . . . . . . . . residente a: . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . .
Dopo essersi qualificato/i ed aver motivato
la visita, il/i sottoscritto/i ha/hanno proceduto al prelievo di
N° . . . . .
. . campioni di:
organi e/o tessuti: . . . . . . . . . . . . .
. . . . . . . . . . . . . alimento per
animali: . . . . . . . . . . . . . . . . . . . . . . . . . . .
...........................................................................................................
altro: . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . ...............................................................................................................................................
Per la ricerca di:
. . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . .
...........................................................................................................
I campioni sono stati suddivisi in N° . . .
. aliquote, ciascuna individuata
rispettivamente dalle
lettere . . . . . . . . . . . . . . . . . . .
. . . . . . . .
Essi sono stati suggellati regolarmente con
piombo recante la sigla . . . . . . . . . . . . . . . . . . . e muniti di cartellini
di identificazione con le rispettive lettere di aliquota e firmati dagli intervenuti.
La/e aliquota/e contrassegnata/e con la/e
lettera/e . . . . . . . . . . . . . . .
. . . . . . . . . . . . è/sono stata/e consegnata/e al Sig. . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . con diffida
di non manometterla/e e di conservarla/e nel seguente modo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . a disposizione dell’interessato/degli interessati che
dovrà/dovranno essere avvertito/i della avvenuto prelievo.
Le altre aliquote vengono inviate presso il
laboratorio d’analisi . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . .
Il/I Sig. . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
in qualità di . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . presente/i all’operazione ha chiesto che
venga verbalizzato quanto segue:
. . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . .
..............................................................................
. . . . . . . . . . .
La merce sopra specificata, della quale il
campione prelevato faceva parte viene
![]()
![]() posta sotto
SEQUESTRO: SI NO
posta sotto
SEQUESTRO: SI NO
Sulla scorta dei rilievi esposti si è redatto
il presente verbale composto da N° . . . . . fogli/o e N°. . . . . allegato/i
in N° . . . . copia/e che il/i Sig. . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . ha/hanno firmato in
originale dopo averne preso visione.
Firma dell’interessato/i Il/i
verbalizzante/i
ALLEGATO 12.
PNR-2003 — RILEVAMENTO PCB, PCDD, E PCDF
1. Il presente allegato contiene indicazioni inerenti l'accertamento dei livelli di PCB, PCDD, e PCDF in varie tipologie di alimenti di particolare interesse per il rilevamento dei tossici medesimi. Il numero di analisi di cui trattasi è complessivamente non inferiore a 1200, così suddivise: almeno 200 analisi per la ricerca delle diossine (PCDD e PCDF) e 1000 per la ricerca di PCB. I gruppi campionari predetti includono alcune matrici reali di controllo di qualità interlaboratorio .
2. Per il rilevamento di PCDD e PCDF verranno determinati quantitativamente i 17 congeneri 2,3,7,8-clorosostituiti, chiaramente identificati nella Parte B delle schede di refertazione di cui al punto 17.
3. Per quanto riguarda i PCB, verranno determinati i sette specifici congeneri con identificazione IUPAC: 28, 52, 101, 118, 138 (+163), 153, e 180. I congeneri dei PCB oggetto di rilevamento sono identificati nella Parte C (Sezione 2.a e Sezione 2.b) delle schede di refertazione di cui al punto 17. I laboratori possono effettuare la determinazione dei PCB totali anche come somma dei gruppi omologhi con grado di clorurazione da tre a otto (T3-, T4-, P5-, H6-, H7-, e O8CB). Al termine delle opportune intercalibrazioni, i PCB totali verranno misurati come somma dei 18 differenti congeneri sottoelencati: 28,52,95,99,101,105,110,118, 138(+163),146,149,151,153,170,177,180,183, 187.
4. A1 macello, il campione elementare non deve essere prelevato da animali provenienti da centri di raccolta, ma esclusivamente da animali provenienti da allevamenti nazionali.
5. In tutti i casi, da ogni lotto prescelto verrà- prelevato un campione da suddividersi in due aliquote tra loro del tutto omogenee. Le matrici da prelevare sono state individuate come riportato al punto 15.
6. I1 campionamento, di tipo completamente casuale e senza blocco dei prodotti, dovrà essere imprevisto, inatteso, ed effettuato in momenti non fissi e in giorni non particolari della settimana. Il campionamento verrà effettuato presso:
- gli stabilimenti di macellazione per le carni;
- gli allevamenti per il latte, uova, e prodotti di acquacoltura;
- gli allevamenti pertinenti per i mangimi (in ogni caso, 50 campioni di mangime per bovine da latte verranno prelevati contestualmente al campionamento di altrettanti reperti di latte bovino così come i 50 campioni di mangime per l'acquacoltura andranno prelevati contestualmente agli animali a cui viene somministrato);
I1 prelievo del campione sarà eseguito solo se sono disponibili informazioni che ne garantiscano la completa tracciabilità, con le modalità indicate al punto 16. Nel caso che la singola unità campionaria (es., pollo leggero, trote, spigole) sia di dimensioni insufficienti per costituire il campione elementare, alla composizione di quest'ultimo concorreranno più esemplari che dovranno essere presenti in modo sostanzialmente uniforme nelle due aliquote finali.
7. Le due aliquote campionate verranno inviate agli IZS competenti per territorio.
8. Gli IZS svolgono le analisi per la ricerca dei PCB secondo protocolli che garantiscano l'affidabilità e la comparabilità dei referti; tali protocolli verranno concordati con l’ISS. Essi altresì provvedono a inviare la seconda aliquota all'IZS dell'Abruzzo e Molise, individuato dal Ministero della Sanità, indicato dall'ISS e intercalibrato con quest'ultimo per l'analisi di PCDD e PCDF. Gli IZS conservano i campioni fino al momento della spedizione al laboratorio suddetto.
9. Il campione deve essere scortato dal verbale di prelevamento conforme all'Allegato 13 del PNR 2001 e, qualora prelevato in allevamento, dal cartellino del mangime ivi utilizzato.
10. In caso di valori per PCBtot superiori al limite di azione di 100 ng/g (base lipidica) adottato per alcune tipologie di alimenti, laddove non sia già stata prevista l'analisi delle diossine, la seconda aliquota del campione verrà inviata all'ISS per accertamenti inerenti tali composti.
11. Quanto espresso al Punto 10, non s'applica alle tipologie alimentari dell'acquacoltura. In particolare, la filiera zootecnica delle trote è stata inserita nei piani di rilevamento sistematico dei PCB per la prima volta nel 1999, quale integrazione del PNR precedentemente definito. Pertanto, il limite d'azione di 100 ng/g ivi individuato per i PCB7 si deve intendere come indicazione provvisoria, quale riferimento analitico per la definizione di adeguate procedure di campionamento e analisi. Per quanto riguarda i mangimi, non vi sono limiti d'azione disponibili.
12. L'Istituto Superiore di Sanità, Laboratorio Nazionale di Riferimento per i Residui, coordina i laboratori incaricati e definisce con i medesimi le procedure di controllo di qualità e intercalibrazione.
13. Dopo verifica della congruità analitica con l'ISS relativamente ai risultati delle diossine e dei PCB nei campioni correlati, i referti devono essere trasmessi dalle ASL alle Regioni con il modello di refertazione mostrato in allegato, costituito delle Parti A, B, e C. Le Regioni trasmettono, comunque, tutti i referti inerenti i PCB al Ministero della Sanità e all'ISS, LNR, entro le scadenze previste. I laboratori devono dare comunicazione immediata di ogni positività al Ministero.
14. Ad interim, la valutazione del rischio tossicologico associata a una eventuale contaminazione da diossine e/o PCB verrà eseguita dall'ISS. L'ISS procederà comunque a un esame del problema per fornire eventuali limiti d'azione. In caso di non conformità sanitaria, si procederà a rintracciare la partita esaminata, che verrà posta sotto sequestro; su di essa verranno effettuati un campionamento ufficiale e nuovi accertamenti analitici. I prodotti alimentari risultati contaminati verranno distrutti.
ALLEGATO
12.17
|
RILEVAMENTO DI PCB, PCDD, E PCDF IN
PRODOTTI ALIMENTARI PIANO NAZIONALE RESIDUI ANNO: Laboratorio |
|
|
Verbale |
|
|
Ente prelevatore |
|
|
Data prelievo / accettazione |
|
|
Regione di prelievo |
|
|
Tipologia del campione |
|
|
% di grasso |
|
|
Il campione è stato selezionato per
analisi di Diossine? (SI/NO) |
|
|
Eventuali variazioni dalla
procedura analitica già riportata |
|
|
Note / commenti |
|
|
Sezioni compilate |
|
|
Analista/compilatore |
|