LA GIUNTA REGIONALE
Omissis
DELIBERA
per le motivazioni espresse in narrativa che qui si intendono integralmente trascritte:
1) di approvare il “Piano controllato di impiego sperimentale della zincobacitracina per l’enterocolite enzootica del coniglio” della Regione Abruzzo, allegato alla presente Deliberazione di cui è parte integrante e sostanziale;
2) che le spese previste ai punti 4., 6. e 7. del Piano in parola, sono a carico dell’allevatore che vi aderisce, mentre le spese previste dall’allegato 7 del Piano, sono a carico della ditta produttrice dei mangimi; pertanto dal presente atto non deriva alcun impegno di spesa a carico della Regione;
3) gli incarichi afferenti il Piano, affidati ai Servizi Veterinari delle Aziende UU.SS.LL. ed all’istituto Zooprofilattico Sperimentale di Teramo, sono meglio specificati ai punti 5., 6. e 7. del Piano stesso;
4) di incaricare il Dirigente del Servizio Veterinario del Settore Sanità della Regione, all’adozione degli atti amministrativi connessi all’applicazione del Piano in parola, ivi comprese eventuali modifiche;
5) di pubblicare il presente provvedimento sul B.U.R.A. (Bollettino Ufficiale della Regione Abruzzo).
REGIONE
ABRUZZO
SETTORE
SANITÀ
SERVIZIO
VETERINARIO
PROGRAMMA D’IMPIEGO CONTROLLATO DELLA ZINCOBACITRACINA
PER L’ENTEROCOLITE DEL CONIGLIO
REGIONE
ABRUZZO
DIREZIONE SANITÀ - SERVIZIO
VETERINARIO
ORDINANZA MINISTERIALE 7/05/02 - PROGRAMMA ESECUTIVO
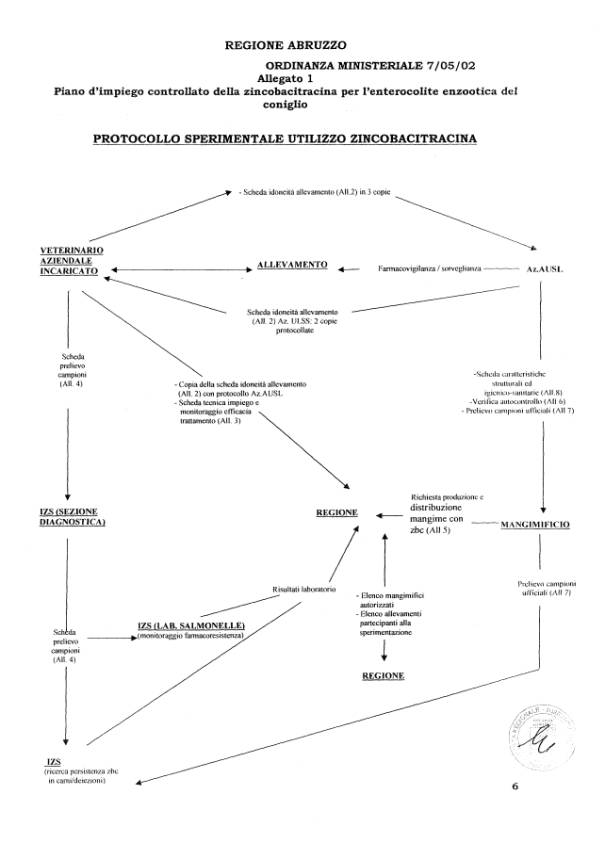
Vista l’Ordinanza del Ministro per la Salute 7 maggio 2002, pubblicata nella Gazzetta Ufficiale n. 137 del 13 giugno 2002, la Regione Abruzzo intende dare attuazione e coordinare il Piano controllato d’impiego sperimentale della zincobacitracina per l’enterocolite enzootica del coniglio” attraverso l’applicazione del presente protocollo.
Tale piano avrà una durata di un anno a partire dal momento dell’approvazione da parte del Ministero. Sul territorio regionale sono individuati ed autorizzati gli allevamenti secondo le modalità di cui al punto 1; l’utilizzo sperimentale della zincobacitracina avviene sotto la responsabilità di veterinari autorizzati individuati secondo le modalità di cui al punto 2, che dovranno applicare il protocollo d’impiego.
Il mangime medicato sarà prodotto dai mangimifici di cui al punto 3.
La corretta attuazione e verifica dell’applicazione delle misure previste dal protocollo d’impiego è garantita dal servizio veterinario delle Az. ULSS competenti.
Ai fini della definizione del presente protocollo sperimentale valgono le seguenti definizioni:
sperimentazione: la sperimentazione della zincobacitracina per la cura dell’enterocolite enzootica del coniglio, ai sensi dell’O.M. 7 maggio 2002;
principio attivo: la zincobacitracina, definita all’art. 1 dell’O.M. 7 maggio 2002;
zincobacitracina: la zincobacitracina, definita all’art. 1 dell’O.M. 7 maggio 2002, tal quale o sotto forma di premiscela, la cui somministrazione è vietata ai riproduttori ed ai soggetti di età inferiore ai 35 giorni;
mangime medicato: il mangime contenente zincobacitracina prodotto per la sperimentazione da ragioni sociali, di cui all’art. 2, comma 1, lettera d), O.M. 7 maggio 2002, autorizzate ai sensi del D.Lgs. 90/93 a produrre mangimi medicati;
partita di mangime medicato: la produzione di mangime medicato di una stessa giornata lavorativa contenente identici livelli di zincobacitracina;
controllo analitico: controllo effettuato per ogni partita di mangime medicato, con un determinato livello di zincobacitracina, prodotto durante la giornata di lavorazione;
fornitori: le ragioni sociali, di cui all’art. 3 comma 1, O.M. 7 maggio 2002, autorizzate ai sensi dell’art. 7, D.Lgs. 119/92, che producono e/o commerciano la zincobacitracina e/o le premiscele che la contengono;
mangimifici: le ragioni sociali, di cui all’art. 2, comma 1, lettera d), O.M. 7 maggio 2002, autorizzate ai sensi del D.Lgs. 90/93 a produrre mangimi medicati, che producono alimenti per animali contenenti zincobacitracina;
allevamenti: gli allevamenti cunicoli, di cui all’art. 2, comma 1, lettera a), O.M. 7 maggio 2002, che intendono attivare la sperimentazione prevista ai sensi dell’ordinanza di cui trattasi, presso i quali è stata:
– diagnosticata, ai sensi dell’art. 1, comma 1 dell’ordinanza 7 maggio 2002, l’enterocolite enzootica del coniglio;
– confermata ufficialmente, ai sensi dell’art. 1, comma 1 dell’ordinanza 7 maggio 2002, l’enterocolite enzootica del coniglio;
– effettuata una valutazione preliminare da parte delle Az. ULSS competenti della situazione igienico sanitaria degli allevamenti e dei risultati ottenuti a seguito dell’applicazione di eventuali misure correttive;
allevamenti registrati: gli allevamenti cunicoli che attivano la sperimentazione;
medico veterinario autorizzato: il medico veterinario, di cui all’art. 2, comma 1, lettera c), autorizzato all’impiego della zincobacitracina, responsabile della sperimentazione presso un determinato allevamento ai sensi del medesimo comma ed ai sensi della Circolare del Ministero della sanità, 25 settembre 1996, n. 14;
Regione: la Regione Abruzzo, Direzione Sanità, Servizio Veterinario;
Az. AUSL: i Servizi d’igiene degli allevamenti e delle produzioni zootecniche delle Az. AA.UU.SS. LL. della Regione Abruzzo;
I.Z.S.: l’Istituto Zooprofilattico Sperimentale dell’Abruzzo e del Molise.
1) Allevamenti potenzialmente soggetti all’applicazione del piano:
Gli allevamenti coinvolti nella sperimentazione sono quelli a ciclo chiuso o da ingrasso. Sono esclusi gli allevamenti per autoconsumo.
Il responsabile dell’allevamento ed il medico veterinario autorizzato di cui al punto 2 compilano la scheda di idoneità dell’allevamento (allegato 2) in triplice copia riportando gli estremi della diagnosi effettuata presso i laboratori territoriali dell’I.Z.S.. La scheda deve essere consegnata all’Az.AUSL competente che provvede ad effettuare il sopralluogo per la verifica dei requisiti igienico sanitari. Verificato il possesso dei requisiti igienico-sanitari le Az.AUSL competenti esprimono il proprio parere favorevole mediante l’allegato 2, trattengono una copia e restituiscono 2 copie al responsabile dell’allevamento che trattiene una copia e ne invia una alla Regione.
Presso la Regione sarà istituito un registro aggiornato degli
allevamenti cunicoli, nei quali è stata ufficialmente diagnosticata
l’enterocolite enzootica, che intendono attivare la sperimentazione con mangime
medicato con zincobacitracina al 5%.
Ogni allevamento registrato deve provvedere alla corretta tenuta del registro dei trattamenti al fine di garantire la tracciabilità del prodotto.
2) Medici Veterinari autorizzati all’impiego:
I veterinari sono autorizzati sulla base dei dati dichiarati in allegato 2 e sono inseriti in un registro tenuto presso la Regione in analogia a quanto previsto all’articolo 13 del D.Lgs 196/99.
Il medico veterinario autorizzato deve:
– -impiegare la zincobacitracina negli allevamenti secondo dosaggi e tempi di sospensione previsti dall’ordinanza ministeriale;
– monitorare l’efficacia e l’innocuità del farmaco compilando la scheda dì cui all’allegato 3 e provvedendo all’invio alla Regione;
– provvedere alla corretta gestione della profilassi igienico-sanitaria dell’allevamento;
– prelevare idonei campioni in allevamento per la verifica della persistenza del principio nelle carni e nelle deiezioni dei soggetti trattati, e per il monitoraggio della farmacoresistenza indotta secondo le modalità di cui ai punti 5 e 6 per il successivo invio all’I.Z.S. accompagnati dalla scheda di prelievo campioni (allegato 4);
– curare la corretta tenuta del registro dei trattamenti allo scopo di garantire la tracciabilità del prodotto;
– comunicare alle Az. ULSS il manifestarsi di effetti indesiderati o avversi riferibili all’utilizzo di mangime medicato con zincobacitracina;
– comunicare alla Regione eventuali variazioni rispetto a quanto dichiarato all’atto della prima autorizzazione.
3) Mangimifici:
Gli stabilimenti, già autorizzati ai sensi del D. L.vo 3 marzo 1993, n.90 e D.M. 16 novembre 1993, che intendono produrre mangime medicato con zincobacitracina al 5% per allevamenti cunicoli, devono inviare la richiesta di cui all’allegato 5 all’Az.AUSL competente per il territorio sede dello stabilimento e alla Regione.
Presso la Regione sarà istituito un registro dei mangimifici autorizzati.
Il responsabile del mangimificio è tenuto a compilare mensilmente la scheda rendicontazione autocontrolli (allegato 6) relativamente alle partite giornalmente prodotte, e a renderla disponibile al personale delle Az.AA.UU.SS.LL. preposto alla vigilanza periodica nello stabilimento.
Il responsabile del mangimificio è tenuto al ritiro degli eventuali quantitativi di mangime medicato con zincobacitracina, mediante idonee procedure, che dovessero residuare in allevamento alla fine dell’utilizzo.
4) Mangimifici con sede di produzione al di fuori del territorio della Regione Abruzzo:
Il responsabile dell’allevamento che intende utilizzare per la sperimentazione il mangime prodotto da un mangimificio con sede di produzione al di fuori del territorio abruzzese, deve inviare alla ASL competente sull’allevamento cunicolo copia del parere rilasciato dalla ASL territorialmente competente sull’impianto di produzione. L’ASL competente sull’allevamento invierà copia di questo parere al Servizio Veterinario della Regione Abruzzo.
5) Attività di vigilanza da parte dell’Az. AUSL competente per territorio:
Le Az. AUSL competenti per territorio dovranno:
– verificare il corretto impiego del medicinale veterinario negli allevamenti, la corretta tenuta del registro dei trattamenti e la tracciabilità dell’utilizzo della zincobacitracina. L’attività di farmacosorveglianza dovrà essere documentata dalle Az. AA.UU.SS.LL.
– verificare l’eventuale manifestarsi di effetti indesiderati o avversi riferibili all’utilizzo di mangime medicato con zincobacitracina. L’attività di farmacovigilanza dovrà essere documentata dalle Az. AA.UU.SS.LL.;
– verificare la persistenza dei requisiti strutturali ed igienico-sanitari dei mangimifici secondo il protocollo di cui all’allegato 8;
– verificare periodicamente l’attività di autocontrollo aziendale dei mangimifici con la vidimazione dell’allegato 6;
– verificare periodicamente nei mangimifici il registro di produzione e distribuzione del mangime medicato per la garanzia della tracciabilità del prodotto;
– prelevare nei mangimifici quando previsto, campioni di mangime per la ricerca della zincobacitracina da inviare all’I.Z.S. secondo quanto riportato in allegato 7 unitamente a copia dell’ultima scheda di rendicontazione compilata.
6) Indagini relative ai residui nelle carni e monitoraggio ambientale:
Al fine di valutare la persistenza del principio attivo in carni e deiezioni, sono eseguiti monitoraggi su un campione statisticamente significativo di allevamenti sottoposti a trattamento con zincobacitracina.
Negli allevamenti individuati dal Regione il veterinario incaricato dovrà provvedere ad effettuare i prelievi in allevamento con frequenza stabilita. I campioni saranno inviati all’I.Z.S. con apposita scheda di prelievo (allegato 4).
7) Monitoraggio della farmacoresistenza indotta:
Al fine di valutare la farmacoresistenza indotta, è eseguito un monitoraggio su un campione statisticamente significativo di allevamenti sottoposti a trattamento con zincobacitracina. Negli allevamenti individuati dalla Regione il veterinario incaricato dovrà provvedere ad effettuare i prelievi in allevamento con frequenza stabilita. I campioni saranno inviati all’I.Z.S. con apposita scheda di prelievo (allegato 4).